Молярная масса стекла: Молярная масса of na2o*cao*6sio2
Получение оргстекла, реакция получения органического стекла
Органическое стекло – один из наиболее востребованных полимерных конструкционных материалов, обладающий высокой прочностью, диэлектрическими свойствами и устойчивостью к действию атмосферных явлений и агрессивных сред. Промышленностью изготавливается бесцветное и окрашенное оргстекло, которое может быть как прозрачным, так и матовым. Материал выпускается в нескольких видах: листовое, блочное оргстекло и цветное оргстекло, а также в виде изделий сложной формы. Оргстекло применяется в строительстве, машиностроении, химической и других отраслях промышленности. Также из него изготавливают различные элементы декора, сувенирную и рекламную продукцию (брелоки, визитницы, вывески и т.д.).
В качестве исходного сырья для получения органического стекла используют метилметакрилат, который получают из метилового спирта и метакриловой кислоты. Оргстекло получают по следующей реакции:
Метилметакрилат – это бесцветная жидкость, которая, вступая в реакцию полимеризации, превращается в стеклообразную массу. Реакция получения оргстекла протекает на свету при нагревании и в присутствии катализаторов (перекись водорода, перекись бензола и др.):
Реакция получения оргстекла протекает на свету при нагревании и в присутствии катализаторов (перекись водорода, перекись бензола и др.):
Конечным продуктом реакции полимеризации является полиметилметакрилат, молярная масса которого составляет 20 000 – 200 000. Этот материал представляет сбой твердое прозрачное вещество, отличающееся высокой ударопрочностью. При нагревании до 100 – 150 0С он становится пластичным, а при более высокой температуре происходит деполимеризация с образованием жидкого метилметакрилата.
Для получения органического стекла в ходе реакции полимеризации в полиметилметакрилат вводятся пластификаторы, красители и различные присадки. Все это позволяет придать оргстеклу требуемый цвет, прозрачность и форму.
Промышленностью выпускается листовое акриловое стекло, а также различные полиметилметакрилатв гранулах, из которого изготавливают оргстекло экструзионным или литьевым методом.
Метод получения оргстекла блочной полимеризацией
Листовое оргстекло получают методом блочной полимеризации, при котором реакция протекает в формах в присутствии инициаторов и пластификаторов. Формы изготавливают из обычного силикатного стекла с толщиной стенки 5 – 11 мм, также применяются стальные и алюминиевые формы. Зазор между листами формы регулируется при помощи эластичных вкладышей, что позволяет получать изделия из оргстекла различной толщины.
Формы изготавливают из обычного силикатного стекла с толщиной стенки 5 – 11 мм, также применяются стальные и алюминиевые формы. Зазор между листами формы регулируется при помощи эластичных вкладышей, что позволяет получать изделия из оргстекла различной толщины.
Технологический процесс производства листового акрилового стекла состоит из нескольких этапов:
Форполимер получают в специальных аппаратах, куда помещают жидкий метилметакрилат с добавлением инициатора (перекись бензола). Для получения вязкой сиропообразной жидкости смесь тщательно перемешивают и нагревают до 70 – 80 0С в течение 2 ч. Также форполимер можно получить, растворив в жидком мономере «крупку», которая представляет собой измельченные обрезки или бракованные листы органического стекла. Для получения требуемой молекулярной массы «крупку» тщательно просеивают и подвергают термообработке.
Перед заливкой в формы в форполимер вводят пластификаторы (фталаты, перкарбонаты), красители, замутнители и другие присадки для получения требуемых свойств готового оргстекла. Для получения однородной смеси полученную массу тщательно перемешивают, фильтруют и подвергают вакуумизации.
Для получения однородной смеси полученную массу тщательно перемешивают, фильтруют и подвергают вакуумизации.
Готовый форполимер заливают в формы, которые размещают на специальных тележках в горизонтальном положении. Процесс полимеризации происходит в туннельных полимеризационных камерах, где формы с форполимером постепенно нагреваются до температуры 120 0С в течение 24 – 48 ч. Для более равномерного прогрева в камерах происходит постоянный обдув форм горячим воздухом.
После окончания реакции полимеризации листы органического стекла охлаждаются, извлекаются из форм и подвергаются окончательной обработке (шлифовка, полировка и т.д.).
Благодаря техническим характеристикам оргстекла, этот материал нашел широкое применение в промышленности. Однако, у многих зачастую встает вопрос: как резать оргстекло в домашних условиях? Подробнее о резке оргстекла читайте в этой статье.
Метод получения органического стекла суспензионной полимеризацией
Для изготовления из органического стекла изделий сложной формы применяют литьевой и экструзионный методы, где в качестве исходного сырья используют гранулированный полиметилметакрилат. Этот материал получают полимеризацией в суспензии, при этом размер гранул полиметилметакрилата зависит от количества и вида стабилизатора, а также скорости перемешивания акриловой смеси. В качестве стабилизаторов обычно применяются метилцеллюлоза, соли полиакриловой кислоты и т.д.
Этот материал получают полимеризацией в суспензии, при этом размер гранул полиметилметакрилата зависит от количества и вида стабилизатора, а также скорости перемешивания акриловой смеси. В качестве стабилизаторов обычно применяются метилцеллюлоза, соли полиакриловой кислоты и т.д.
Полимеризацию проводят в автоклаве под давлением 0,3 – 0,5 МПа. На первом этапе в автоклав заливают жидкий мономер, дистиллированную воду и стабилизатор суспензии. Полученную смесь перемешивают и вводят в нее пластификаторы, красители и инициаторы. Затем акриловая масса нагревается до температуры полимеризации, которая составляет 70 – 75 0С, но допускаются и более высокие значения до 120 – 130 0С. Для придания материалу специальных свойств в акриловую массу также добавляют термостабилизаторы, регуляторы молекулярной массы и др. Длительность процесса полимеризации составляет до 4 ч.
После завершения полимеризации гранулы полиметилметакрилата отделяют от жидкости центрифугированием, а затем промывают и просушивают при температуре 100 0С. Готовый гранулированный полимер расфасовывают в упаковки или отправляют на переработку.
Готовый гранулированный полимер расфасовывают в упаковки или отправляют на переработку.
Из полимеров, размеры частиц которых не превышают 0,2 мм, органическое стекло получают методом горячего прессования. Полимеры же с более крупными гранулами используют для изготовления оргстекла литьевым и экструзионным методом.
Аналітична та фізико-колоїдна хіміяТема 5 Кислотно-основное титрование (метод нейтрализации) Тренажер к теме 5
- Теоретические сведения
- Расчеты в титриметрическом анализе
- Выполнение опыта
- 3. Контрольное определение серной кислоты
- 4. Защита лабораторной работы
Лабораторная работа
Определение содержания серной кислоты в технической серной кислоте
Для выполнения работы используют метод нейтрализации ( кислотно -основного взаимодействия) , в основе которого положена реакция взаимодействия ионов водорода с гидроксид — ионами :
Н + + ОН = Н2О
Количество серной кислоты определяют по титруемому раствору щелочи ( КОН или NaОН).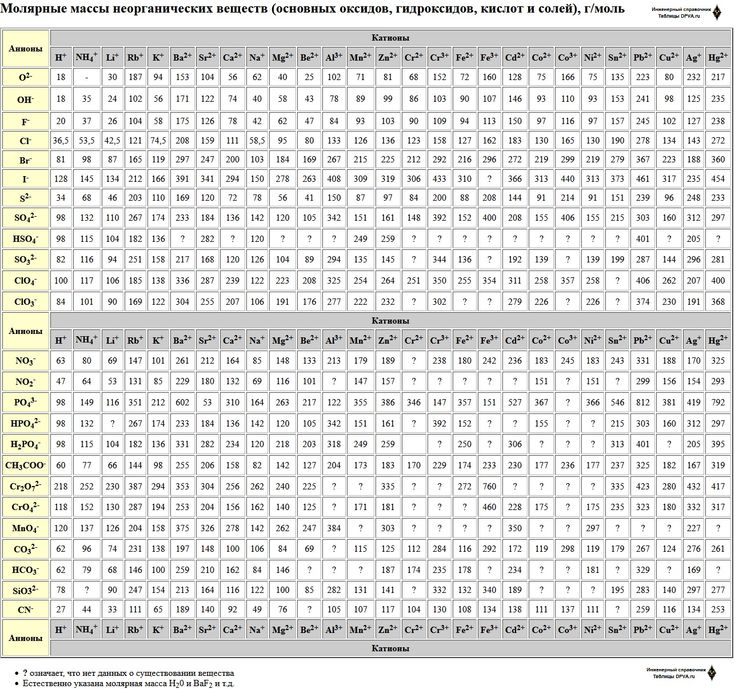 Раствор реактива известной концентрации называется рабочим, или титрованным , раствором. Лучшим методом приготовления титрованных рабочих растворов является растворение точной навески соответствующего чистого вещества в определенном объеме воды. Но изготовить титрованные рабочие растворы щелочи таким методом нельзя, так как при их хранении всегда образуется определенное количество соды в результате поглощения углекислого газа из воздуха. Кроме того, щелочи содержат воду и другие примеси. Итак, приготовить титрованные растворы щелочи из точной навески нельзя. Поэтому в методе нейтрализации растворы приготавливают приблизительной концентрации, а затем устанавливают точную нормальность растворов с помощью исходных веществ.
Раствор реактива известной концентрации называется рабочим, или титрованным , раствором. Лучшим методом приготовления титрованных рабочих растворов является растворение точной навески соответствующего чистого вещества в определенном объеме воды. Но изготовить титрованные рабочие растворы щелочи таким методом нельзя, так как при их хранении всегда образуется определенное количество соды в результате поглощения углекислого газа из воздуха. Кроме того, щелочи содержат воду и другие примеси. Итак, приготовить титрованные растворы щелочи из точной навески нельзя. Поэтому в методе нейтрализации растворы приготавливают приблизительной концентрации, а затем устанавливают точную нормальность растворов с помощью исходных веществ.
Для установления нормальности серной кислоты чаще используют щавелевую кислоту.
Процесс добавления рабочего раствора к раствору определяемого вещества называется титрованием. Обычно титруют до того момента, пока будет достигнута точка эквивалентности , то есть момента , когда количество реактива в объеме рабочего раствора , станет эквивалентно количеству определяемого вещества.
Точку эквивалентности обычно устанавливают, вводя в раствор вещества, способные менять свой цвет после введения рабочего раствора в эквивалентном количестве или в небольшом избытке. Это вещества называются индикаторами. Наиболее часто используют индикаторы фенолфталеин, метилоранж, лакмус .
Основой титриметрического (объемного) анализа является закон эквивалентов, согласно которому вещества реагируют друг с другом в эквивалентных соотношениях
CN1 . V1 = CN2 . V2, (1)
где CN1 и CN2 — молярная концентрация эквивалентов растворов, рабочего и определяемого, соответственно, моль экв / л; V1, V2 — объемы растворов, рабочего и определяемого, соответственно, л.
Молярная концентрация эквивалентов (нормальная концентрация, нормальность) показывает число моль эквивалентов вещества, растворенного в 1 л раствора
СN = m/( meq. V), (2),
V), (2),
где СN — молярная концентрация эквивалентов раствора, моль экв / л; m — масса растворенного вещества, г; meq — молярная масса эквивалента растворенного вещества, г / моль; V — объем раствора, мл.
Титр показывает число граммов растворенного вещества, содержащегося в 1 мл рабочего раствора
T = m/V = (CN∙ meq)/1000, (3)
Титр по определяемому веществу показывает, какая масса определяемого вещества эквивалентна одному миллилитру рабочего раствора данной концентрации
Тx/y = (CNxmeq)/1000, (4)
где CNx — молярная концентрация эквивалентов рабочего раствора, моль экв / л;
mey — молярная масса эквивалента определяемого вещества, г / моль.
Результате прямого титрования в граммах вычисляют по формуле
m = (CN meq V)/1000, (5)
где СN — молярная концентрация эквивалентов рабочего раствора, моль экв / л;
m — масса определяемого вещества, г;
V — объем мерной колбы, мл.
- 1. Приготовление примерно 0,1 н. раствора NaOH
- 1.1. На основании формулы (5) рассчитать массу навески натрия гидроксида, которая необходима для приготовления примерно 0,1 н. раствора. Для приготовления раствора выберите один из предложенных вариантов:
- Таблица 1.1
Вариант | Vколби, см3 | mєNaOH,г/моль | mNaOH,г |
А | 1000 | ||
В | 500 |
Верные ответы
Вариант | Vколби, см3 | mєNaOH,г/моль | mNaOH,г |
А | 1000 | 40,01 | 4. |
В | 500 | 40,01 | 2,00 |
Если расчеты выполнены правильно, то появляется надпись «Расчеты сделаны правильно и можно приступать к взвешиванию». Если расчеты сделаны неправильно, то появляется надпись «Вы неправильно рассчитали массу навески натрия гидроксида, повторите расчеты». Если студент неправильно посчитал 2 раза, то появляется надпись « Сравните правильность расчетов с контрольной таблицей 1.1 и найдите ошибку в своих расчетах ».
1.2 Для взвешивания рассчитанной массы NaOH используйте лабораторное стекло, аналитические весы и шпатель.
На экран монитора нужно вывести поочередно рисунки, чтобы студент представлял, как данные предметы выглядят в действительности.
Рис. 1.1. Лабораторное стекло для взвешивания
Рис. 1.2. Электронные весы
Рис. 1.3. Шпатель
1. 3. Положите стекло для взвешивания на чашку весов. Запишите значение массы стекла, которое появилось на дисплее весов.
3. Положите стекло для взвешивания на чашку весов. Запишите значение массы стекла, которое появилось на дисплее весов.
Масса стекла для взвешивания_________г. Масса стекла для взвешивания, которое появляется на дисплее весов — 3,50 г.
1.4. Гидроксид натрия — это кристаллическое вещество белого цвета. Отбирать его необходимо с помощью шпателя. При этом на мониторе появляется рисунок
Рис. 1.4. Внешний вид гидроксида натрия
1.5. Снимите с чашки весов лабораторное стекло и положите его перед весами.(Когда студент снимет стекло с чашки весов, на дасплее весов появится значение 0,00) Запомните, что категорически запрещается насыпать реактивы на стекло, если оно находится на чашке, поскольку при этом часть вещества может попасть на саму чашку, которая отразится на точности взвешивания и загрязнит(или совсем испортит) лабораторное оборудование.
предостережение нужно выразительно выделить цветом и шрифтом, чтобы привлечь к нему внимание!
1. 6. Наберите шпателем небольшое количество гидроксида натрия и осторожно высыпьте его на лабораторное стекло. Поместите стекло с гидроксидом натрия на чашку весов и наблюдайте за дисплеем весов. Если на дисплее появится значение меньше или больше, чем 5,50 (масса стекла + масса навески = 3,50 + 4,00 = 7,50 г –ВАРИАНТ А или 3,50+2,00= 5,50- ВАРИАНТ В), то снимите с чашки весов лабораторное стекло с навеской гидроксида натрияи добавьте или отберите небольшую порцию гидроксида натрия.
6. Наберите шпателем небольшое количество гидроксида натрия и осторожно высыпьте его на лабораторное стекло. Поместите стекло с гидроксидом натрия на чашку весов и наблюдайте за дисплеем весов. Если на дисплее появится значение меньше или больше, чем 5,50 (масса стекла + масса навески = 3,50 + 4,00 = 7,50 г –ВАРИАНТ А или 3,50+2,00= 5,50- ВАРИАНТ В), то снимите с чашки весов лабораторное стекло с навеской гидроксида натрияи добавьте или отберите небольшую порцию гидроксида натрия.
Снова поместите лабораторное стекло с навеской на чашку весов . Повторяйте эту операцию, пока на дисплее весов не появится значение 7,50 (5,50).
стекло с навеской гидроксида натрия
2. Можно приступать к приготовлению раствора
На экране должна появиться картинка
мерная колбаворонка
промывалка
Рис.2.1. Лабораторная посуда для приготовления стандартного раствора.
На экране появляется мерная колба и воронка (рис.2.2а), далее студент берет воронку в руку и вставляет в мерную колбу(рис. 2.2б).
2.2б).
а б
Рис.2.2
На экране далее появляется лабораторное стекло с навеской соли (рис.2.3а) и студент берет стекло рукой и вставляет в воронку, но руку не отпускает, а держит лабораторное стекло над воронкой (рис.2.3б).
А б
Рис.2.3
2.2 Дополнительно появляется на экране промывалка водой (рис.2.1). Далее студент второй рукой берет промывалку с водой и начинает аккуратно смывать кристаллики едкого натра в мерную колбу (рис.2.4) при этом на картинке должно быть показано, что количество гидроксида натрия на лабораторном стекле убывает и затем вообще исчезает, а на дне колбы появляется осадок. Примерно заполнено одна треть объема колбы жидкостью. Студент убирает лабораторное стекло и воронку. Если студент убирает лабораторное стекло с кристалликами вещества, то появляется надпись: «Вы потеряли определенное количество NaOH и раствор не будет содержать рассчитанное количество, смойте натрий гидроксид полностью со стекла в колбу » И возврат к пункту 2.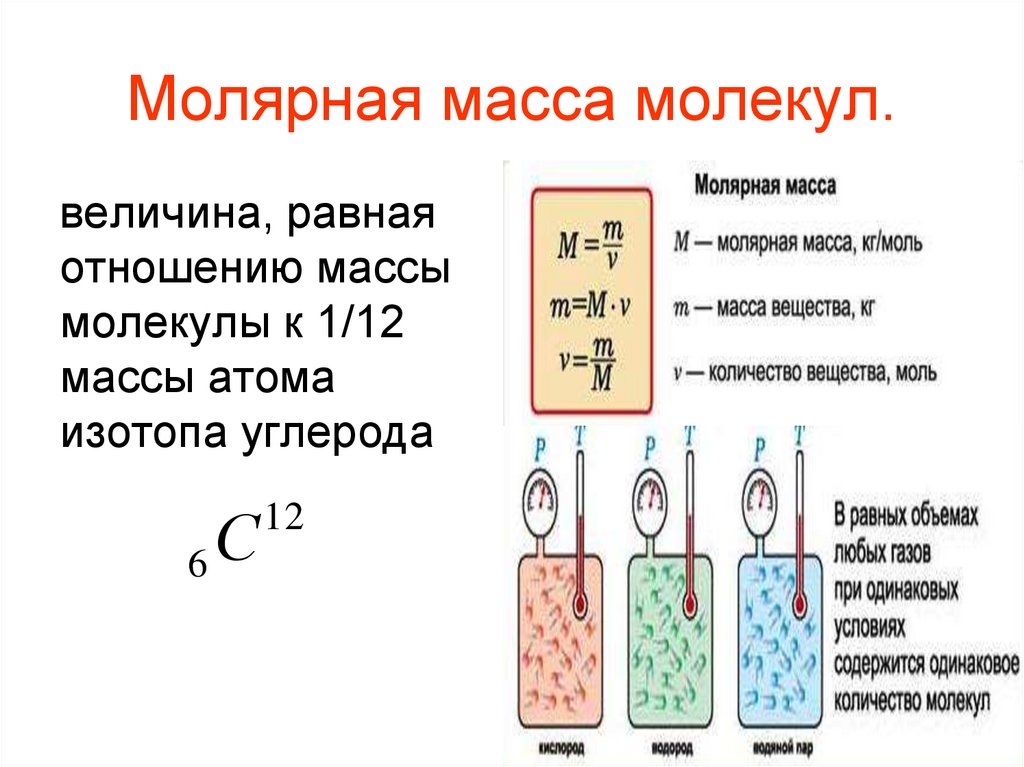 2
2
Рис 2.4. (на промывалке надпись НСl нужно будет убрать, а написать Н2О)
2.3 Появляется надпись ««Необходимо размешать содержимое колбы до полного растворения». На экране появляется пробка. Студент берет рукой пробку и закрывает отверстие мерной колбы (рис. 2.5а). Далее берет мерную колбу в руку и начинает перемешивать (практически покачивать ее) до полного растворения вещества (рис.2.5б) (при этом кристаллики постепенно исчезают). Если вещество растворилась, то появляется надпись «Можно продолжать приготовления раствора заданной концентрации». Если студент прекратил перемешивание, а вещество еще есть в колбе, то появляется надпись «Вещество не растворилась, продолжайте перемешивание». Студент должен далее продолжать покачивание колбы.
аб
Рис.2.5
Появляется надпись «Можно продолжать приготовления раствора заданной концентрации»
2.4 Студент снимает одной рукой пробку и начинает приливать воду из промывалки в мерную колбу (рис. 2.6б). На экране появляется промывалка с водой, студент берет ее рукой и приливает раствор (рис.2.6а). Когда раствор заходит в узкое горлышко мерной колбы, рядом высвечивается картинка с вогнутым мениском слоя жидкости.
2.6б). На экране появляется промывалка с водой, студент берет ее рукой и приливает раствор (рис.2.6а). Когда раствор заходит в узкое горлышко мерной колбы, рядом высвечивается картинка с вогнутым мениском слоя жидкости.
а б Рис.2.6.
рис. 2.7. Соотношение вогнутого мениска и отметки на шейке мерной колбы.
Если студент налил больше воды, чем необходимо появляется надпись «К сожалению, Вы набрали избыток воды, попробуйте еще раз» и возврат к пункту 2.4. Если количество раствора ниже мениска, то появляется надпись «Необходимо добавить еще воды до вогнутого мениска».. Если зеркало будет отвечать рис.2.7, то появляется надпись «Раствор приготовлен правильно, выполняйте работу дальше. Вам необходимо перемешать содержимое мерной колбы для равномерного распределения вещества в растворе ».
2.5 Далее повторяется пункт 2.3, то есть закрывают одной рукой пробкой мерную колбу и поворачивают несколько раз колбу рукой.
Рис. 2.8. Перемешивание раствора
Появляется надпись «Можете приступать к определению точной концентрации приготовленного раствора щелочи»
На экране появляется картинка штатива с закрепленными в нем двумя бюретками с надписями на одной 0,1н H2C2O4, а на другой 0,1н. NaOH(рис.2.9), конической колбы(рис.2.10), капельницы с надписью фенолфталеин(рис.2.11)
Рис 2.9. Бюретки
Рис 2.10. Коническая
колба
рис.2.11. Капельница
- Студент берет коническую колбу в руку, подносит к бюретке с надписью ) 0,1н.Н2С2О4, приливает из бюретки точно 20 см3 раствора щавелевой кислоты, затем берет в руку капельницу с надписью фенолфталеин и в эту же колбу добавляет из капельницы 2 или три капли раствора фенолфталеина. Затем подностит эту колбу к бюретке с надписью 0,1н.
 NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 15,00 см3, а для варианта В 18,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись: «Вы недотитровали, повторите титрование», а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование».
NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 15,00 см3, а для варианта В 18,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись: «Вы недотитровали, повторите титрование», а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование». - 2.6. Далее на мониторе появляется надпись: «На основании экспериментальных данных сделает расчеты и заполните таблицу»:
- Табл.. 2.1
Vh3C2O4,см3 | Т h3C2O4,г/см3 | VNaOH,см3 | ТNaOH,г/см3 | NNaOH,моль/л |
А. | 0,004501 | 15,00 | ||
В. 20,00 | 0,004501 | 18,00 |
Верные ответы
Табл.. 2.1
Vh3C2O4,см3 | Т h3C2O4,г/см3 | VNaOH,см3 | ТNaOH,г/см3 | NNaOH,моль/л |
А. 20,00 | 0,004501 | 15,00 | 0,005247 | 0,1318 |
В. 20,00 | 0,004501 | 18,00 | 0,004435 | 0,1108 |
Если расчеты выполнены правильно, то появляется надпись «Расчеты сделаны правильно и можно приступать к контрольному определения серной кислоты». Если расчеты сделаны неправильно, то появляется надпись «Вы неправильно рассчитали массу, титр и нормальную концентрацию раствора натрия гидроксида, повторите расчеты». Если студент неправильно посчитал 2 раза, то появляется надпись «Сравните правильность расчетов с контрольной таблицей 2.1 и найдите ошибку в своих расчетах».
Если расчеты сделаны неправильно, то появляется надпись «Вы неправильно рассчитали массу, титр и нормальную концентрацию раствора натрия гидроксида, повторите расчеты». Если студент неправильно посчитал 2 раза, то появляется надпись «Сравните правильность расчетов с контрольной таблицей 2.1 и найдите ошибку в своих расчетах».
3.1.На экране появляются отдельно мерная колба № 1 объёмом 100 см3 и пипетка (2.14а), коническая колба и капельница с фенолфталеином. Студент берет пипетку в руку, одевает грушу на пипетку (2.14б), нажимает грушу и опускает пипетку в колбу №1 (2.14в), далее потихоньку отпускает грушу и происходит заполнение пипетки до деления выше 10 (примерно до 12)
Рис 2.14а Рис 2.14б Рис. 2.14в
3.2. Далее вытаскивает пипетку из мерной колбы, так, чтобы кончик оставался в колбе. Затем быстро снимает грушу и зажимает пальчиком отверстие пипетки (рис. 2.15а). Медленно отпускает пальчик и с пипетки начинают капать капельки назад в мерную колбу, пока раствор в пипетке не достигнет заданного уровня по мениску пипетки 10 мл (рис.2.15б). Если студент набрал больше раствора, чем необходимо появляется надпись «К сожалению, Вы набрали избыток раствора, попробуйте еще раз» и возврат к пункту 3.1. Если количество раствора ниже мениска, то появляется надпись «Необходимо добавить еще раствора до вогнутого мениска». Если зеркало будет отвечать рис.2.15(б), то появляется надпись «Раствор отобран правильно, выполняйте работу дальше».
2.15а). Медленно отпускает пальчик и с пипетки начинают капать капельки назад в мерную колбу, пока раствор в пипетке не достигнет заданного уровня по мениску пипетки 10 мл (рис.2.15б). Если студент набрал больше раствора, чем необходимо появляется надпись «К сожалению, Вы набрали избыток раствора, попробуйте еще раз» и возврат к пункту 3.1. Если количество раствора ниже мениска, то появляется надпись «Необходимо добавить еще раствора до вогнутого мениска». Если зеркало будет отвечать рис.2.15(б), то появляется надпись «Раствор отобран правильно, выполняйте работу дальше».
а б вв
Рис.2.15
- 3.3 Студент вынимает пипетку и переносит раствор в коническую колбу (рис.2.15в), добавляет туда 2-3 капли фенолфталеина из капельницы.
- 3.4. На экране появляется бюретка с надписью 0,1н.NaOH. . Студент подностит колбу к бюретке с надписью 0,1н.
 NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 12,00 см3, а для варианта В 15,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись «Вы недотитровали, повторите титрования », а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование»
NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 12,00 см3, а для варианта В 15,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись «Вы недотитровали, повторите титрования », а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование» - 4. Обработка результатов анализа
Используя данные титрования, рассчитайте массу серной кислоты, которая содержится в пробе для анализа. Для этого Вам нужно воспользоваться формулами (1) и (5). По результатам расчетов заполните таблицу:
Табл. 4.1.
4.1.
варіант | VNaOH,см3 | Vh3SO4,см3 | N h3SO4, моль/л | m h3SO4,г |
А | 12,00 | 10,00 | ||
В | 15,00 | 10,00 |
Верные ответы
варіант | VNaOH,см3 | Vh3SO4,см3 | N h3SO4, моль/л | m h3SO4,г |
А | 12,00 | 10,00 | 0,1098 | 0,5380 |
В | 15,00 | 10,00 | 0,0739 | 0,3619 |
Для защиты лабораторной работы не обходимо пройти тестирование
На этом этапе, при тестировании у студента не должно быть возможности возвращаться к любому пункту данной лабораторной работы!
1. Чему равен фактор эквивалентности серной кислоты?
Чему равен фактор эквивалентности серной кислоты?
А). 1/3 моль б). 1/5 в). 1/5 г). 1
Верный ответ б)
2. Чему равен титр раствора KCl, в 500 мл которого содержится 3,8260 г соли?
А). 0,007652 г/мл б). 0,003826 г/мл в). 3,8260 г/мл г). 0,001913 г/мл
Верный ответ а)
3. На титрование раствора соляной кислоты израсходовано 10,00 мл раствора NaOH c TNaOH/HCl= 0,003874 г/мл. Сколько граммов HCl содержится в растворе?
А). 0,003874 б). 0,038740 в). 0,387400 г). 0,0003874
Верный ответ б)
4. На титрование 10 мл 1 н. раствора соляной кислоты израсходовано 10 мл раствора гидроксида натрия. Чему равна нормальная концентрация раствора гидроксида натрия?
А) 2 моль/л б) 1 моль/л в) 0,5 моль/л г) 0,25 моль/л
Верный ответ б)
5. Сколько граммов серной кислоты содержится в 100 мл раствора с титром 0,000002 г/мл?
А) 2 б) 0,000020 в) 0,000002 г) 0,000200
Верный ответ г)
6. Чему равен эквивалент щавелевой кислоты Н2С2О4?
А) 1/3 б) 1/6 в) 1/2 г) 1
Верный ответ в)
7. В 1 л раствора серной кислоты содержится 0,0049 г H2SO4.Чему равна нормальная концентрация этого раствора?
В 1 л раствора серной кислоты содержится 0,0049 г H2SO4.Чему равна нормальная концентрация этого раствора?
А) 0,0001 моль/л б) 0.00005 моль/л в) 0,0010 моль/л г) 1,0000 моль/л
Верный ответ а)
8.Чему равен эквивалент серной кислоты?
А) 1 б) 1/2 в) 1/4 г) 1/3
Верный ответ б)
9. Титр раствора гидроксида натрия равен 0,040000 г/мл. Сколько граммов NaOH содержится в 100 мл этого раствора?
А) 2,0000 г б) 4,0000 г в) 0,0400 г г) 0,0200 г
Верный ответ б)
10. Вычислить нормальность раствора серной кислоты, если в 1 л раствора содержится 49 г H2SO4
А) 0,1000 б) 1,0000 в) 0,5000 г) 2,0000
Верный ответ б)
Учебные ресурсы ChemSpace | Оплата учителям Учителя
Эмпирические и молекулярные формулы Карточка с заданиями Google Самопроверка
By ChemSpace
Привлеките своих студентов-химиков, используя эту самопроверку, чтобы попрактиковаться в эмпирических и молекулярных формулах. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью
Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью
Предметы:
Естествознание, химия
Классы:
10 th , 11 th , 12 th
Типы:
Рабочие листы, Ресурсы, Приложения Google
3 900 Онлайн
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Расчет молярной массы Google Self-Check Maze
By ChemSpace
Привлеките своих студентов-химиков, используя эту самопроверку, чтобы попрактиковаться в вычислении молярных масс соединений. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут испытывать трудности, а также отстаивать
Предметы:
Наука, Химия
Классы:
10 th , 11 th , 12 th
Типы:
Рабочие листы, Ресурсы, Приложения Google
3 900 Онлайн
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Химия Набор витражей ко Дню святого Валентина
By ChemSpace
В этот комплект входят только витражи ко Дню святого Валентина. В этот комплект входят три продукта, в том числе: Молярная масса Витражное стеклоЧастицы в моли Витражное стеклоГраммы в моль Витражное стеклоВы также можете приобрести мой Химия
В этот комплект входят три продукта, в том числе: Молярная масса Витражное стеклоЧастицы в моли Витражное стеклоГраммы в моль Витражное стеклоВы также можете приобрести мой Химия
Предметы:
Наука, Химия
Оценки:
10 TH , 11 TH , 12 TH
Типы:
Рабочие листы, действия
$ 6,00
$ 5.40
Bundle
$.
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Балансировка химических уравнений Google Shape Image Reveal
By ChemSpace
Привлеките своих студентов-химиков, используя это упражнение для самопроверки, чтобы попрактиковаться в составлении химических уравнений. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью, когда
Субъекты:
Science, Chemistry
Оценки:
10 TH , 11 TH , 12 TH
Типы:
Рабочие утечки, мероприятия, Google Apps
$ 3,00
онлайн онлайн онлайн.
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Молекулярные формулы Google Self-Check Maze
By ChemSpace
Привлеките своих студентов-химиков, используя это задание с самопроверкой, чтобы попрактиковаться в вычислении молекулярных формул. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью
субъекты:
Science, Chemistry
Оценки:
10 TH , 11 TH , 12 TH
Типы:
Рабочие листы, мероприятия, Google Apps
$ 3,00
онлайн -листы онлайн.
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Mole-Volume Google Self-Check Maze
By ChemSpace
Привлеките своих студентов-химиков, используя это упражнение для самопроверки, чтобы попрактиковаться в подсчете литров газов при задании молей или игр в STP. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться,
Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться,
Темы:
Science, Chemistry
Оценки:
10 TH , 11 TH , 12 TH
Типы:
Рабочие листы, мероприятия, Google Apps
$ 3,00
онлайн -ресурс онлайн -ресурс онлайн -ресурс.
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Химический витраж — НАБОР ДЛЯ ВЫРАЩИВАНИЯ
By ChemSpace
ПОЛУЧИТЕ ЭТОТ НАБОР СКИДКОЙ 20%!!!!Это РАСТУЩИЙ набор всех моих витражей для моего магазина химии! На данный момент планируется добавить более 12 страниц с витражами. Цена будет увеличиваться по мере добавления нового витража
Субъекты:
Science, Chemistry
Оценки:
TH , 10 TH , 11 TH , 12 TH
.
Комплект
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Балансирующие химические уравнения Вырезать и вставить
By ChemSpace
Привлеките своих студентов-химиков, используя это забавное задание по вырезанию и вставке, чтобы попрактиковаться в составлении химических уравнений. Как это работает: Учащиеся будут смотреть на каждое записанное химическое уравнение, а затем находить коэффициенты, вырезая нижнюю часть.0015 th
Типы:
Рабочие листы, Действия
2,00 $
Интернет-ресурс
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Эмпирические и молекулярные формулы Витражное стекло
Автор ChemSpace
Заинтересуйте своих студентов-химиков, используя это веселое раскрашивающее задание, чтобы отработать эмпирические и молекулярные формулы. Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: Учащиеся будут использовать линейку или линейку
Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: Учащиеся будут использовать линейку или линейку
Предметы:
Естествознание, химия
Классы:
10 th , 11 th , 12 th
Типы:
Рабочие листы, Действия
$2.00
Интернет-ресурс
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Витражное стекло Percent Composition
By ChemSpace
Привлеките своих студентов-химиков, используя это веселое раскрашивание, чтобы попрактиковаться в процентном составе. Этот рабочий лист помогает с самооценкой благодаря созданию витражного вида. Как это работает: учащиеся будут использовать линейку или прямой край, чтобы соединить
Субъекты:
Science, Chemistry
Оценки:
10 TH , 11 TH , 12 TH
Типы:
Рабочие листы, мероприятия
$ 2,00
онлайн -ресурс.
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Грамм на моль Витражное стекло
By ChemSpace
Привлеките своих студентов-химиков к этому веселому раскрашиванию, чтобы попрактиковаться в преобразовании граммов в моли и наоборот. Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: Учащиеся будут использовать линейку или линейку для
Предметы:
Естествознание, химия
Оценки:
10 th , 11 th , 12 th
Типы:
Рабочие листы, Действия
$2.00
Интернет-ресурс
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Витраж от частиц до молей
By ChemSpace
Привлеките своих студентов-химиков, используя это веселое раскрашивание, чтобы попрактиковаться в превращении частиц в моли и наоборот. Этот рабочий лист помогает с самооценкой благодаря созданию витража. Как это работает: Учащиеся будут использовать линейку или линейку
Этот рабочий лист помогает с самооценкой благодаря созданию витража. Как это работает: Учащиеся будут использовать линейку или линейку
Предметы:
Наука, химия
, 12 th
Типы:
Рабочие листы, Действия
2,00 $
Интернет-ресурс
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Витражное стекло с молярной массой
Автор ChemSpace
Вовлеките своих студентов-химиков, используя это веселое раскрашивание, чтобы попрактиковаться в вычислении молекулярной массы. Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: Учащиеся будут использовать линейку или линейку для
Предметы:
Наука, химия
Классы:
9 , 10 th , 11 th , 12 th
Типы:
Рабочие листы, Действия
$2. 00
00
Интернет-ресурс
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Написание химических формул Витраж
By ChemSpace
Привлеките своих студентов-химиков, используя это веселое раскрашивание, чтобы попрактиковаться в написании формул для соединений. Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: учащиеся будут использовать линейку или линейку
Субъекты:
Science, Chemistry
Оценки:
10 TH , 11 TH , 12 TH
Типы:
Рабочие листы, мероприятия
$ 2,00
онлайн -ресурс.
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Стехиометрическое витражное стекло
By ChemSpace
Привлеките своих студентов-химиков, используя это веселое раскрашивание, чтобы попрактиковаться в стехиометрии. Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: Учащиеся будут использовать линейку или линейку, чтобы соединить
Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: Учащиеся будут использовать линейку или линейку, чтобы соединить
Предметы:
Естествознание, химия
Оценки:
10 th , 11 th , 12 th
Типы:
Рабочие листы, Действия
$2.00
Интернет-ресурс
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Номенклатура Мухобойка
Автор: ChemSpace
Привлеките своих студентов-химиков, используя эту игру-мухобойку, чтобы попрактиковаться в химической номенклатуре. Студенты не только учатся, они кинестетически закрепляют это. Это упражнение можно использовать индивидуально или в группах.0015 th
Типы:
Презентации PowerPoint, занятия
4,00 $
Цифровая загрузка
ZIP (6,50 МБ)
ДОБАВИТЬ В КОРЗИНУ
СПИСОК ПОЖЕЛАНИЙ
Моль-моль Стехиометрия Карточки с заданиями Google Самопроверка
Автор ChemSpace
Вовлеките своих студентов-химиков, используя это упражнение для самопроверки, чтобы попрактиковаться в моль-мольной стехиометрии. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью, когда они
Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью, когда они
Предметы:
Наука, химия
Классы:
10 th , 11 th , 12 th
Типы:
Рабочие листы, Активности, Google Apps
БЕСПЛАТНО
Интернет-ресурс
Папка Google Drive™
СПИСОК ПОЖЕЛАНИЙ
Эмпирические формулы Google Self-Check WS
By ChemSpace
Привлеките своих студентов-химиков, используя эту самопроверку, чтобы попрактиковаться в вычислении эмпирических формул. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью
Субъекты:
Химия
Оценки:
10 TH , 11 TH , 12 TH
Типы:
Рабочие листы, мероприятия, Google Apps
Free
онлайн -ресурс онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайн -онлайно.
Папка Google Drive™
WISH LIST
Значимые цифры в математических расчетах Витраж
By ChemSpace
Привлеките своих студентов-химиков, используя это веселое раскрашивание, чтобы попрактиковаться в математических вычислениях. Этот рабочий лист помогает с самооценкой благодаря созданию вида витража. Как это работает: Учащиеся будут использовать линейку или
Предметы:
Наука, Химия
Классы:
10 th , 11 th , 12 th
Типы:
Рабочие листы, ресурсы
3 БЕСПЛАТНО
Папка Google Drive™
СПИСОК ПОЖЕЛАНИЙ
Расчет молярности Раскраска Google Self-Check
Автор ChemSpace
Вовлеките своих студентов-химиков, используя это задание для самопроверки, чтобы попрактиковаться в расчетах молярности. Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью, когда они
Функция самопроверки в этом ресурсе помогает учащимся определить вопросы, с которыми они могут столкнуться, а также обратиться за помощью, когда они
Предметы:
Наука, химия
Классы:
10 th , 11 th , 12 th
Типы:
Рабочие листы, Активности, Google Apps
$3.00
Интернет-ресурс
Папка Google Диска™
ДОБАВИТЬ В КОРЗИНУ
WISH LIST
Оптические свойства стекла на основе теллурита висмута
1. Виджая Пракаш Г., Нараяна Рао Д., Бхатнагар А.К. Линейно-оптические свойства теллуритных стекол на основе ниобия. Твердотельный коммун. 2001;119: 39–44. [Google Scholar]
2. Мохамед Н.Б., Яхья А.К., Дени М.С.М., Мохамед С.Н., Халима М.К., Сидек Х.А.А. Влияние одновременного восстановления TeO 2 и добавления ZnO на упругие и структурные свойства стекла (90– x )TeO 2 –10Nb 2 O 5 – ( x )ZnO. J. Некристалл. Твердые вещества. 2010; 356:1626–1630. [Google Scholar]
J. Некристалл. Твердые вещества. 2010; 356:1626–1630. [Google Scholar]
3. Фолдвари И., Питер А. Основные спектроскопические свойства оксида висмута теллура Bi 2 TeO 5 . Дж. Матер. науч. 1992; 27: 750–754. [Google Scholar]
4. Удович М., Валант М., Суворов Д. Фазообразование и диэлектрические характеристики системы Bi 2 O 3 –TeO 2 , приготовленной в атмосфере кислорода. Варенье. Керам. соц. 2004; 87: 591–597. [Google Scholar]
5. Озданова Дж., Тича Х., Тихи Л. Оптическая запрещенная зона и спектры комбинационного рассеяния в некоторых (Bi 2 O 3 ) x (WO 3 ) ) у (TeO 2 ) 100− x − y and (PbO) x (WO 3 ) y (TeO 2 ) 100− x − y очки. J. Некристалл. Твердые вещества. 2009; 355: 2318–2322. [Google Scholar]
J. Некристалл. Твердые вещества. 2009; 355: 2318–2322. [Google Scholar]
6. Boyer J.C., Vetrone F., Capobianco J.A. Оптические переходы и ап-конверсионные свойства Ho 3+ легированный ZnO–TeO 2 стекло. Дж. Заявл. физ. 2003;93:9460–9465. [Google Scholar]
7. Мори Х., Китами Т., Саката Х. Электропроводность стекол W 2 O 5 –Sb 2 O 3 –TeO 2 . J. Некристалл. Твердые вещества. 1994; 168: 157–166. [Google Scholar]
8. Шу С.П., Чанг Ф.-С. Импедансное исследование стекол V 2 O 5 –TeO 2 –BaO. Твердотельный ион. 2005; 176: 2695–2699. [Академия Google]
9. Аюни Дж.Н., Халима М.К., Талиб З.А., Сидек Х.А.А., Дауд В.М., Зайдан А.В., Хамирул А.М. Оптические свойства тройной системы TeO 2 –B 2 O 3 –стекло ZnO. Матер. науч. англ. 2011; 17 doi: 10.1088/1757-899X/17/1/012027. [CrossRef] [Google Scholar]
10. Мохамед Н.Б., Яхья А.К., Дени М.С.М., Мохамед С.Н., Халима М.К., Сидек Х.А.А. Влияние одновременного восстановления TeO 2 и добавления ZnO на упругие и структурные свойства (90–x)TeO 2 –10Nb 2 O 5 –(x)ZnO стекло. J. Некристалл. Твердые вещества. 2010; 356:1626–1630. [Google Scholar]
Мохамед Н.Б., Яхья А.К., Дени М.С.М., Мохамед С.Н., Халима М.К., Сидек Х.А.А. Влияние одновременного восстановления TeO 2 и добавления ZnO на упругие и структурные свойства (90–x)TeO 2 –10Nb 2 O 5 –(x)ZnO стекло. J. Некристалл. Твердые вещества. 2010; 356:1626–1630. [Google Scholar]
11. Борис Л.С., Петров Т., Йонеда Х., Росица Т., Бориана М. Синтез и нелинейно-оптические свойства TeO 2 –Bi 2 O 3 –GeO 2 очки. Скр. Матер. 2009; 61: 493–496. [Google Scholar]
12. Дурга Д.К., Вирайа Н. Диэлектрическая дисперсия в ZnF 2 –Bi 2 O 3 –TeO 2 стеклянная система. Дж. Матер. науч. 2001; 36: 5625–5632. [Google Scholar]
13. Юсеф Э.С.С. Характеристика оксифторид-теллуритных стекол с помощью тепловых, оптических и ультразвуковых измерений. Дж. Физ. Д заявл. физ. 2005; 38:3970–3975. [Google Scholar]
14. Xu T., Chen F. , Dai S., Shen X., Wang X., Nie Q., Liu C. Стеклообразование и оптические нелинейные свойства третьего порядка в TeO 2 – Bi 2 O 3 – псевдотройная система BaO. J. Некристалл. Твердые вещества. 2011;357:2219–2222. [Google Scholar]
, Dai S., Shen X., Wang X., Nie Q., Liu C. Стеклообразование и оптические нелинейные свойства третьего порядка в TeO 2 – Bi 2 O 3 – псевдотройная система BaO. J. Некристалл. Твердые вещества. 2011;357:2219–2222. [Google Scholar]
15. Senthil Murugan G., Fargin E., Rodriguez V., Adamietz F., Couzi M., Buffeteau T., Le Coustumer P. Электрические полюса TeO 2 –Bi при нагревании. 2 O 3 – стекла ZnO для нелинейного оптического применения. J. Некристалл. Твердые вещества. 2004; 344: 158–166. [Google Scholar]
16. Wang Y., Dai S., Chen F., Xu T., Nie Q. Физические свойства и оптическая ширина запрещенной зоны новых теллуритных стекол в составе TeO 2 –Nb 2 О 5 –Би 2 О 3 система. Матер. хим. физ. 2009; 113:407–411. [Google Scholar]
17. Эль-Маллавани Р.А.Х. Справочник по теллуритовым очкам. КПР Пресс Инк; Бока-Ратон, Флорида, США: 2002. [Google Scholar]
[Google Scholar]
18. Эль-Маллаванни Р., Дирар Абдалла М., Аббас Ахмед И. Новое теллуритовое стекло: оптические свойства. Матер. хим. физ. 2008; 109: 291–296. [Google Scholar]
19. Сидек Х.А.А., Росмавати С., Талиб З.А., Халима М.К., Дауд В.М. Синтез и оптические свойства ZnO–TeO 2 стеклянная система. Являюсь. Дж. Заявл. науч. 2009; 6: 1489–1494. [Google Scholar]
20. Саддик Ю.Б., Яссер Б., Афифи Х.А., Абд Эль-Аал Н.С. Интерпретация механических свойств и структуры стекол TeO 2 –Li 2 O–B 2 O 3 . физ. Б. 2007; 398:1–7. [Google Scholar]
21. Халимах М.К., Сидек Х.А.А., Дауд В.М., Зайнал А.С., Мансор Х., Хамирул А.М. Физические свойства бинарной системы теллуритного стекла. Науки о твердом теле. Тех. 2010;18:364–370. [Академия Google]
22. Муньос-Матин Д., Вильегас М.А., Гонсало Дж., Фернандес-Наварро Дж.М. Характеристика стекол в системе TeO 2 –WO 3 –PbO. Дж. Евр.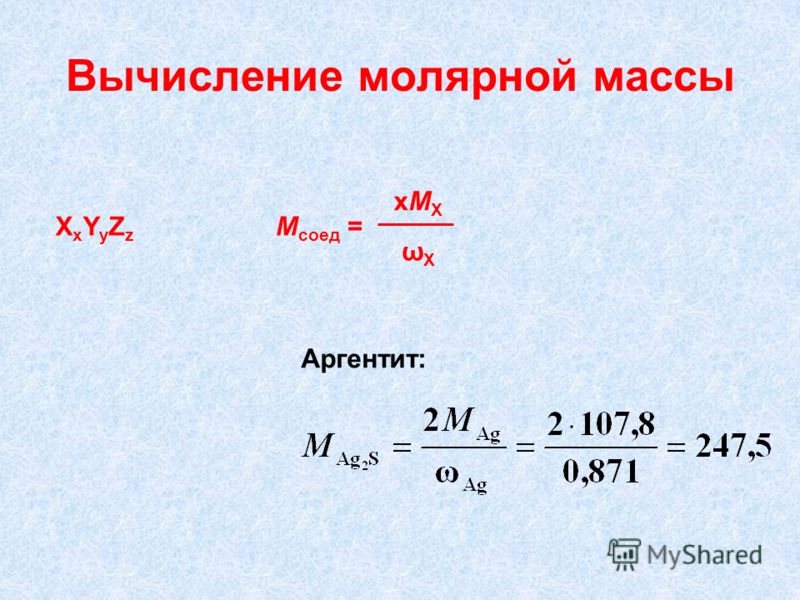 Керам. соц. 2009;29:2903–2913. [Google Scholar]
Керам. соц. 2009;29:2903–2913. [Google Scholar]
23. Довейдар Х., Саддик Ю.Б. FTIR и ультразвуковые исследования модифицированных боратных висмутовых стекол. J. Некристалл. Твердые вещества. 2009; 355:348–354. [Google Scholar]
24. Ванга Г., Жанга Дж., Дайя С., Вена Л., Янга Дж., Цзянга З. Структурное исследование TeO 2 –BiCl 3 стекловидная система. Дж. Мол. Структура 2005; 750:1–6. [Google Scholar]
25. Ок К.М., Бхуванеш Н.С.П., Шив Халасямани П. Би 2 TeO 5 : Синтез, структура и свойства генерации второй гармоники порошка. неорг. хим. 2001; 40:1978–1980. [PubMed] [Google Scholar]
26. Pascuta P., Culea E. FTIR-спектроскопическое исследование некоторых висмутовых зародышевых стекол, содержащих ионы гадолиния. Матер. лат. 2008;62:4127–4129. [Академия Google]
27. Раджендран В., Паланивелу Н., Чаудхури Б.К., Госвами К. Характеристика полупроводниковых V 2 O 5 –Bi 2 O 3 –TeO 3 через 90sonic очки.
 00
00 NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 15,00 см3, а для варианта В 18,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись: «Вы недотитровали, повторите титрование», а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование».
NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 15,00 см3, а для варианта В 18,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись: «Вы недотитровали, повторите титрование», а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование». 20,00
20,00 NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 12,00 см3, а для варианта В 15,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись «Вы недотитровали, повторите титрования », а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование»
NaOH и по каплям начинает приливать раствор щелочи из бюретки в колбу до тех пор, пока раствор в колбе не окрасится в малиновый цвет. Это произойдет на отметке бюретки для варианта А 12,00 см3, а для варианта В 15,00 см3. До этих отметок раствор в колбе должен оставаться бесцветным. Если студент перестает титровать до этих отметок, появляется надпись «Вы недотитровали, повторите титрования », а если продолжает приливать раствор щелочи из бюретки после них, то появляется надпись «Вы перетитровали, повторите титрование»