Молярная масса стекла: Молярная масса of na2o*cao*6sio2
Молярная масса — определение термина
Термин и определение
масса, деленная на количество вещества; рекомендуемой единицей измерения молярной массы является грамм на моль (г/моль), поскольку в этом случае численные значения молярной массы и относительной молекулярной массы вещества равны.
Еще термины по предмету «Материаловедение»
Энтропия смешения
изменение (прирост) энтропии при образовании раствора из смеси компонентов.
Эффект Мессбауэра
явление резонансного поглощения или испускания γквантов решеткой (системой связанных атомных ядер) без изменения внутренней энергии тела; лежит в основе ядерной гамма-резонансной спектроскопии (ЯГР-спектроскопия), используемой для изучения сверхтонких взаимодействий в твердых телах.
Эффективная масса
эквивалентная масса носителя заряда, характеризующая его движение в потенциальном поле кристаллической решетки.
Похожие
Кажущаяся молярная масса (кажущаяся молекулярная масса)
Средняя молекулярная масса (средняя молярная масса)
Молярная теплоемкость
Молярный показатель поглощения
Молярная (мольная) концентрация
Масса
Массив
Молярная концентрация, мольная доля, мольная концентарция, молярная доля
Буксируемая масса
Пластические массы
Добавочная масса
Ледяной массив
Масса атмосферы
Масс-спектрограф
Местная масса
Водная масса
Воздушная масса
Масса прибыли
Формовочная масса
Удельная масса
Смотреть больше терминов
Научные статьи на тему «Молярная масса»
(давлении в одну атмосферу или, что тоже самое $p={10}^5Па=760\ мм\ рт.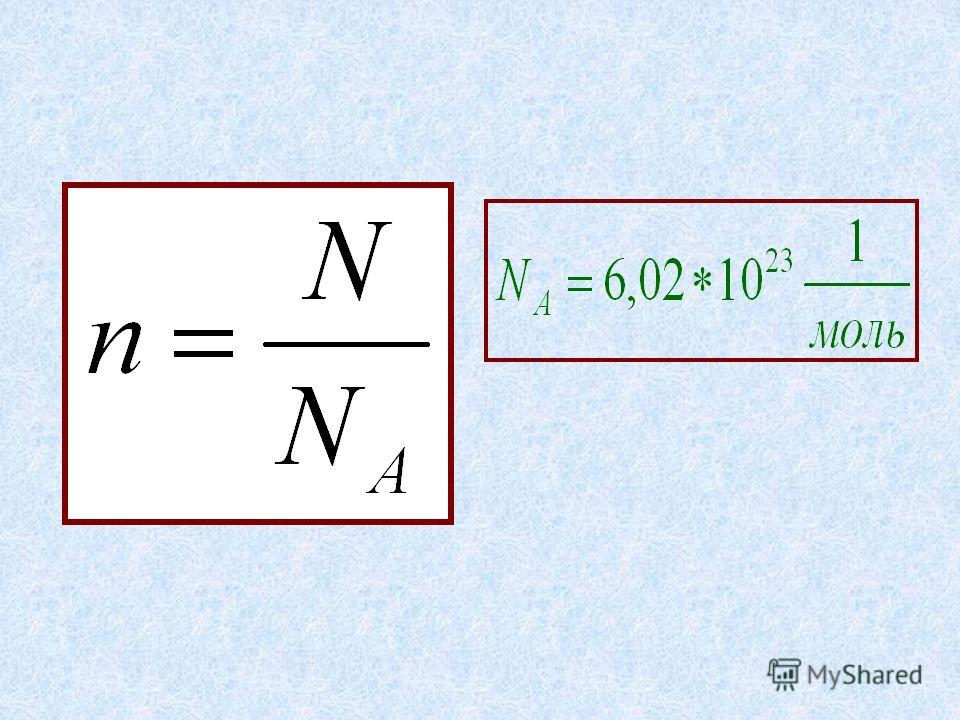 o C$) молярный объем…
o C$) молярный объем…
Как следствие из закона Авогадро отношение плотностей идеальных газов равно отношению их молярных масс…
Относительную плотность чаще всего вычисляют по отношению к воздуху или водороду, используя, что молярные…
Решение:
Найдем молярную массу искомого вещества по формуле, если известно, что ${\mu }_{H_2}$=2$\frac…
\[{\mu }_{C_2H_6O}=24+6+16=46\ \left(\frac{г}{моль}\right)(2.3)\]
Полученная молярная масса в формуле
Статья от экспертов
Научный журнал
Creative Commons
Такой объем называется молярным и обозначается $V_m$….
называют молярной и обозначают как $M$….
$M = \frac{m}{\nu}$,
где $m$ — масса измеряемого вещества….
Для справки: молярная масса железа составляет 55,845 г/моль. …
…
Выразим количество вещества из формулы молярной массы:
$\nu = \frac{m}{M}$
Подставив числовые значения
Статья от экспертов
Исследованы полициклические ароматические углеводороды ( ПАУ), которые широко распространены в углеводородных фракциях нефти и нефтяных остатков, компонентах каменноугольной смолы и продуктах сгорания моторных и судовых топлив. Для прогнозирования физико-химических свойств ПАУ разработаны QSPR-модели на основе квантово-химических дескрипторов. В качестве физико-химических свойств ПАУ изучены: молярная масса, температура кипения, коэффициент распределения октанол/вода. В качестве квантово-хими…
Научный журнал
Creative Commons
Повышай знания с онлайн-тренажером от Автор24!
- 📝 Напиши термин
- ✍️ Выбери определение из предложенных или загрузи свое
- 🤝 Тренажер от Автор24 поможет тебе выучить термины, с помощью удобных и приятных
карточек
Возможность создать свои термины в разработке
Еще чуть-чуть и ты сможешь писать определения на платформе Автор24.
Укажи почту и мы пришлем уведомление с обновлением ☺️
Силикат натрия
Силикатами (с латинского языка слово «silex» переводится как «камень») называются соли метакремниевой кислоты h3SiO3. Например, силикат натрия, химическая формула которого записывается так: Na2SiO3. Другое название соли — натрий метасиликат. Молярная масса вещества равняется 122,06 г/моль. Внешний вид — белые непрозрачные кристаллы, имеющие зеленоватый оттенок. Плотность равняется 2,4 г/см3. Степень чистоты характеризуется показателем преломления, который равняется 1,52. Температура плавления — плюс 1088 °C. Вещество растворимо в воде и нерастворимо в спирте. Разбавленный водный раствор обладает уникальными свойствами: погруженные в него свежие яйца могут до девяти месяцев сохраняться при комнатной температуре. Силикат натрия стабилен в нейтральной и щелочной среде, а в кислой анион SiO3- реагирует с катионами H+ с образованием кремниевой кислоты.
Двуокись кремния (называется еще кремниевым ангидридом или кремнеземом) является наиболее устойчивым соединением, которое встречается в природе в виде кварца. На его долю приходится 12 % массы всей земной коры. Кварц, загрязненный примесями, представляет собой обычный песок, который образуется из-за разрушения горных пород. Под действием щелочи на двуокись кремния протекает химическая реакция: NaOH + SiO2 → Na2SiO3 + h3O. В результате образуется соль кремниевой кислоты — силикат натрия. Гидролиз соли (разложение ее водой) идет по схеме: 2Na2SiO3 + h3O → Na2SiO5 + 2NaOH, и образуется двуметасиликат натрия. С понижением концентрации раствора, гидролиз протекает интенсивнее. В 1 н. растворе гидролизуется 14 % соли, в 0,1 н. — 28 %, в 0,001 % — 32 %. Гидролиз двуметасиликата натрия протекает уже слабее.
На его долю приходится 12 % массы всей земной коры. Кварц, загрязненный примесями, представляет собой обычный песок, который образуется из-за разрушения горных пород. Под действием щелочи на двуокись кремния протекает химическая реакция: NaOH + SiO2 → Na2SiO3 + h3O. В результате образуется соль кремниевой кислоты — силикат натрия. Гидролиз соли (разложение ее водой) идет по схеме: 2Na2SiO3 + h3O → Na2SiO5 + 2NaOH, и образуется двуметасиликат натрия. С понижением концентрации раствора, гидролиз протекает интенсивнее. В 1 н. растворе гидролизуется 14 % соли, в 0,1 н. — 28 %, в 0,001 % — 32 %. Гидролиз двуметасиликата натрия протекает уже слабее.
Силикат натрия образуется в результате взаимодействия кремния со щелочью: Si +h3O + 2NaOH → Na2SiO3 + 2h3. Подобная реакция может протекать со слабыми щелочами, а также очень легко идет с водой в присутствии даже незначительного количества анионов OH-: достаточно следов щелочей, извлеченных из стекла. Так как образующийся метасиликат натрия является солью слабой метакремневой кислоты, то в разбавленном растворе она почти полностью гидролизуется, концентрация ионов OH- в ходе реакции не уменьшается, поэтому все сводится к разложению кремнием воды. Присутствующие следы щелочи являются катализатором. Из 0,63 кг кремния таким способом получается 1 м3 водорода, тогда как железа потребовалось бы почти в 4 раза больше.
Присутствующие следы щелочи являются катализатором. Из 0,63 кг кремния таким способом получается 1 м3 водорода, тогда как железа потребовалось бы почти в 4 раза больше.
В промышленности различные марки силиката натрия характеризуются соотношением количества SiO2 и Na2O. Оно может меняться от 2:1 до 3,75:1. Сорта с соотношением 2,85:1 и ниже считаются щелочными. Те, у которых более высокое соотношение характеризуются, как «нейтральные». Силикат натрия в виде водных концентрированных растворов представляют собой жидкое или растворимое стекло. Но наряду с Na2SiO3 в жидком стекле присутствуют и другие силикаты натрия, поэтому его обычный состав выражается формулой, которая является приближенной, Na2O • nSiO2, где n = 2÷4. Постепенное отщепление SiO2 (обычно при длительном хранении) приводит к помутнению жидкого стекла или к превращению иногда в студнеобразную массу. Поэтому в лаборатории его держат в сосудах, закрытых резиновыми пробками, так как корковые или стеклянные к горлышку просто приклеиваются.
Силикат натрия применяется в производстве стиральных порошков. Ежегодное производство жидкого стекла составляет сотни тысяч тонн. Его используют для укрепления грунтов при проведении строительных работ (например, защита бетонной стяжки пола против истирания), а также, как и другие реагенты, например, триполифосфат натрия, применяется во многих отраслях (обе соли, например, используются для умягчения воды). Пропитка Na2SiO3 автомобильных бетонных дорог в значительной мере сокращает их истирание.
Обработка дерева или других материалов защищает от возгорания (например, постройки или театральные декорации). Часто служит в качестве основы для огнеупорных замазок или канцелярского клея. Простые по составу замазки пригодны для склеивания фарфора и стекла. Их можно получить, смешивая (до консистенции теста) мел с жидким стеклом. Смесь быстро затвердевает и превращается в белую и очень прочную массу.
Из цемента, замешанного на жидком стекле, делают быстро твердеющую замазку, которую используют для склеивания камней. Смесь силиката натрия с опилками используют для заполнения пространства между двойными стенками у некоторых сейфов. Это делает их более огнестойкими, а также служит дополнительной защитой от вскрытия с помощью ацетиленовой горелки из-за сильного задымления и срабатывания сигнализации.
Смесь силиката натрия с опилками используют для заполнения пространства между двойными стенками у некоторых сейфов. Это делает их более огнестойкими, а также служит дополнительной защитой от вскрытия с помощью ацетиленовой горелки из-за сильного задымления и срабатывания сигнализации.
Атомная масса: определение, единицы измерения и способы расчета
Все, с чем вы ежедневно взаимодействуете, в конечном счете состоит из атомов. Стакан воды объемом 200 мл, например, содержит около 6,7 × 10 24 молекул, а поскольку число атомов в каждой молекуле равно трем, всего в одном стакане содержится около 2 × 10 25 атомов. . Это 20 миллионов миллиардов миллиардов — число настолько большое, что вы даже не можете его представить, — и это всего лишь в довольно маленьком стакане воды. Понимание этих крошечных составляющих материи — важный шаг к пониманию макроскопических свойств, с которыми мы знакомы изо дня в день.
Но как вообще можно посчитать что-то вроде числа атомов в стакане воды? Хитрость в этом конкретном случае заключалась в использовании молярной массы воды и известного числа атомов в моле любого вещества. Но молярная масса, в свою очередь, зависит от единиц атомной массы , что крайне важно для понимания любого изучающего физику или химию. К счастью, это действительно упрощение фактической массы атома любого вещества, которое, по сути, говорит вам об относительной массе по сравнению с одним нейтроном или протоном.
Но молярная масса, в свою очередь, зависит от единиц атомной массы , что крайне важно для понимания любого изучающего физику или химию. К счастью, это действительно упрощение фактической массы атома любого вещества, которое, по сути, говорит вам об относительной массе по сравнению с одним нейтроном или протоном.
Структура атома
Атомы состоят из трех основных компонентов: протонов, нейтронов и электронов. Протоны и нейтроны существуют внутри ядра, которое представляет собой компактное расположение материи, находящейся в центре атома, а электроны существуют в виде «нечеткого облака» вокруг него снаружи. Между ядром и даже ближайшим к нему электроном есть огромное пространство. Ядро имеет положительный заряд, потому что протоны заряжены положительно, а нейтроны нейтральны, а облако электронов несет отрицательный заряд, который уравновешивает заряд нейтрона.
Ядро содержит большую часть массы атома, потому что нейтроны и протоны намного, намного тяжелее электронов. Фактически, протоны или нейтроны примерно в 1800 раз больше электронов, настолько больше, что во многих случаях вы можете спокойно пренебречь массой электрона, когда думаете об атомной массе в более общем смысле.
Фактически, протоны или нейтроны примерно в 1800 раз больше электронов, настолько больше, что во многих случаях вы можете спокойно пренебречь массой электрона, когда думаете об атомной массе в более общем смысле.
Атомный номер
В периодической таблице перечислены все элементы (т. е. типы атомов), встречающиеся в природе, начиная с простейшего — атома водорода. 9Атомный номер 0009 атома (данный символом Z ) говорит вам, сколько протонов атом элемента имеет в своем ядре, и это верхнее число в соответствующем блоке периодической таблицы. Поскольку он несет положительный заряд, а количество электронов (что является важной частью информации, когда вы думаете об атомных связях) должно быть равно этому, чтобы обеспечить общую электрическую нейтральность, это число действительно характеризует элемент.
Могут быть разные 9Однако 0009 изотопов одного и того же элемента, которые имеют одинаковое количество протонов (и поэтому их можно разумно рассматривать как один и тот же элемент), но разное количество нейтронов. Они могут быть или не быть стабильными, что само по себе является интересной темой, но сейчас важно отметить, что разные изотопы имеют разные массы, но одинаковые общие свойства в большинстве других аспектов.
Они могут быть или не быть стабильными, что само по себе является интересной темой, но сейчас важно отметить, что разные изотопы имеют разные массы, но одинаковые общие свойства в большинстве других аспектов.
Хотя атомы в своей обычной форме электрически нейтральны, некоторые атомы склонны приобретать или терять электроны, что может придавать им суммарный электрический заряд. Атомы, подвергшиеся одному из этих процессов, называются ионами.
Атомная масса
Атомная масса обычно определяется в единицах атомной массы (а.е.м.). Официальное определение состоит в том, что 1 а.е.м. составляет 1/12 массы атома углерода-12. Здесь углерод-12 — это стандартный способ сказать «изотоп углерода с шестью протонами и шестью нейтронами», поэтому вы можете в конечном итоге думать об атомной единице массы как о массе протона или нейтрона. Таким образом, атомное массовое число — это число протонов и нейтронов в ядре, а это означает, что оно не совпадает с атомным номером 9. 0009 З .
0009 З .
Важно отметить, что по причинам, объясненным в предыдущем разделе, массой электронов в атоме пренебрегают, когда вы говорите об атомной массе в большинстве ситуаций. Еще одно интересное замечание заключается в том, что масса атома на самом деле немного меньше, чем масса всех компонентов вместе взятых, из-за «энергии связи», необходимой для удержания ядра вместе. Однако это еще одно осложнение, которое вам не нужно учитывать в большинстве ситуаций.
Нижнее число в блоке элемента в периодической таблице представляет собой среднюю атомную массу, которая также отличается от массы, выраженной в единицах атомной массы. По сути, это средневзвешенное значение масс различных изотопов элемента с учетом их относительной распространенности на Земле. Так что в некотором смысле это наиболее точная «общая» мера массы элемента, но на практике атомная масса любого конкретного изотопа будет целым числом в единицах атомной массы. В более простых периодических таблицах это «число атомной массы» ( A ) используется вместо средней атомной массы.
Молекулярная масса
Молекулярная масса (или, если использовать менее точный, но также распространенный термин, «молекулярная масса») — это масса молекулы вещества в единицах атомной массы. Выяснить это очень просто: вы находите химическую формулу рассматриваемого вещества, а затем складываете атомные массы составляющих его атомов. Например, метан состоит из одного атома углерода и четырех атомов водорода, поэтому он имеет общую массу этих компонентов. Один атом углерода-12 имеет атомную массу 12, а каждый атом водорода имеет атомную массу 1, поэтому общая молекулярная масса молекулы метана составляет 16 а.е.м.
Молярная масса
Молярная масса вещества – это масса одного моля вещества. Это основано на числе Авогадро, которое говорит вам о количестве атомов или молекул в одном моле вещества, и определении моля. Моль – это количество вещества, при котором его масса в граммах равна его атомному массовому числу. Так, например, для углерода-12 один моль имеет массу 12 г.
Так, например, для углерода-12 один моль имеет массу 12 г.
Число Авогадро равно 6,022 × 10 23 , поэтому 12 г углерода-12 содержит столько же атомов, и аналогично 4 г гелия тоже содержит столько же атомов. Важно помнить, что если рассматриваемое вещество является молекулой (то есть чем-то, состоящим из более чем одного атома), то число Авогадро говорит вам о числе 9.0009 молекул , а не количество атомов.
Это дает вам все, что вам нужно знать, чтобы рассмотреть пример, подобный приведенному во введении со стаканом воды. Стакан содержал 200 мл, что соответствует 200 г по массе, и одна молекула воды (химическая формула H 2 O) имеет два атома водорода и один атом кислорода, для молекулярной массы 18 а.е.м. и молярной массы 18 г. Итак, чтобы найти количество атомов, вы просто делите массу на массу моля, чтобы найти количество молей, а затем умножаете на число Авогадро, чтобы найти количество молекул. Наконец, заметив, что каждая молекула состоит из трех атомов, вы умножаете ее на три, чтобы найти количество отдельных атомов. 9{25} \text{atomic} \end{aligned}
9{25} \text{atomic} \end{aligned}
Примеры – масса углерода
Работа с дополнительными примерами поможет вам понять ключевые понятия об атомной массе. Самый простой пример — определение массы простого элемента, такого как углерод-12. Процесс действительно прост, если вы думаете исключительно с точки зрения а.е.м., но вы также можете довольно легко преобразовать а.е.м. в кг, чтобы получить более стандартизированное измерение массы углерода.
Вы должны быть в состоянии рассчитать массу атома углерода в а.е.м. на основе того, что вы уже узнали из статьи, и учитывая, что в каждом атоме шесть протонов и шесть нейтронов. Так какова же масса атома углерода в аму? Конечно, это 12 а.е.м. Вы добавляете шесть протонов к шести нейтронам и получаете ответ, поскольку оба типа частиц имеют массу 1 а.е.м. 9{−26}\text{ кг}
Это на самом деле крошечная масса (поэтому вместо этого атомная масса обычно измеряется в а. е.м.), но стоит отметить, что масса электрона составляет около 9 × 10 − 31 , поэтому ясно, что даже добавление всех 12 электронов к массе атома углерода не дало бы заметной разницы.
е.м.), но стоит отметить, что масса электрона составляет около 9 × 10 − 31 , поэтому ясно, что даже добавление всех 12 электронов к массе атома углерода не дало бы заметной разницы.
Примеры – Молекулярный вес
Молекулярный вес немного сложнее, чем просто вычисление массы атома, но все, что вам нужно сделать, это посмотреть на химическую формулу молекулы и объединить массы отдельных атомов, чтобы найти сумму. Например, попробуйте вычислить массу бензола, имеющего химическую формулу: C 6 H 6 , отметив, что это атомы углерода-12, и это обычный изотоп водорода, а не дейтерия или трития.
Суть в том, что у вас есть шесть атомов углерода-12 и шесть атомов водорода, поэтому масса молекулы равна:
\begin{aligned} \text{Молекулярная масса} &= (6 × 12 \text{ аму}) + (6 × 1 \text{ аму}) \\ &= 72 \text{ аму} + 6 \text{ аму} \\ &= 78 \text{ аму} \end{aligned}
Процесс Определение молекулярной массы может стать немного более сложным для более крупных молекул, но всегда происходит один и тот же процесс.
Примеры – расчет средней атомной массы
Определение средней атомной массы элемента включает рассмотрение как атомной массы , так и относительного содержания определенного изотопа на Земле. Углерод является хорошим примером этого, поскольку 98,9% всего углерода на Земле — это углерод-12, 1,1% — углерод-13 и очень небольшой процент — углерода-14, которым можно смело пренебречь.
Процесс вычисления этого на самом деле довольно прост: умножьте пропорцию изотопа на массу изотопа в а.е.м., а затем сложите их вместе. Углерод-12 является наиболее распространенным изотопом углерода, поэтому можно ожидать, что результат будет очень близок к 12 а.е.м. Не забудьте преобразовать проценты в десятичные числа (разделить их на 100) перед расчетом, и вы получите правильный ответ:
(12 \text{ а.е.м.} × 0,989) + (13 \text{ а.е.м.} × 0,011) = 12,011 \text{ а.е.м.}
. масса, а не масса наиболее распространенного изотопа.
Стехиометрия — Молекулярная масса | Шмуп
Предыдущий
Следующий
Молекулярная масса
Теперь, когда мы знаем все об атомных массах, мы можем перейти к более крупным и лучшим вещам…молекулам. (Может быть, не , а лучше . Мы не хотим оскорбить все атомы.) Если мы знаем атомные массы отдельных атомов, мы можем легко вычислить массу молекулы. Молекулярная масса (иногда называемая молекулярной массой ) — это просто сумма атомных масс в молекуле.
Какова молекулярная масса воды (H 2 О)? Для вычисления молекулярной массы складываем атомные массы двух атомов водорода и одного атома кислорода:
молекулярная масса H 2 O = 2(атомная масса H) + атомная масса O
Где находим атомную массу масса Н и О? Вытащите свою любимую периодическую таблицу. Мы знаем, мы тоже любим периодическую таблицу.
Мы знаем, мы тоже любим периодическую таблицу.
молекулярная масса H 2 O = 2(1,008 а.е.м.) + 16,00 а.е.м. = 18,02 а.е.м.
Из молекулярной массы можно определить молярную массу молекулы. Как следует из названия, молярная масса — это масса (в граммах) одного моля соединения. Нам даже не нужен калькулятор, чтобы вычислить между молекулярной массой и молярной массой… численные значения одинаковы. Молярная масса соединения (в граммах) численно равна его молекулярной массе (в а.е.м.).
Мы только что подсчитали, что молекулярная масса воды составляет 18,02 а.е.м. К счастью для нас (еще раз спасибо гномам-химикам), его молярная масса составляет 18,02 г. Это означает, что 1 моль воды равен 18,02 г.
Давайте рассмотрим это в перспективе. Примерно 1,2 столовые ложки воды равны 18,02 граммам. Эти 18,02 грамма представляют собой один моль воды. Это означает, что каждые 1,2 столовые ложки воды содержат 6,023 x 10 23 H 2 молекул O. Подумайте об этом в следующий раз, когда выпьете стакан воды. Кто знал, что мы пьем так много молекул?
Подумайте об этом в следующий раз, когда выпьете стакан воды. Кто знал, что мы пьем так много молекул?
Пример задачи
Одним из основных компонентов природного газа является метан (CH 4 ). Сколько молей CH 4 присутствуют в 4,83 г CH 4?
Метан = CH 4
Прежде всего, нам даны граммы CH 4 и нужно найти моли CH 4 . Это означает, что нам нужен коэффициент преобразования между граммами и молями. Еще раз, периодическая таблица — ваш лучший друг. Нам нужно собрать атомные массы углерода и водорода из таблицы Менделеева, а затем вычислить молекулярную массу CH 4 простым сложением.
Молярная масса CH 4 = атомная масса углерода + 4 (атомная масса водорода)
Примечание: мы умножаем на 4, потому что в каждом СН 4 атома водорода 4 .
Молярная масса CH 4 = 12,01 г + 4(1,008 г)
Молярная масса CH 4 = 16,04 г
Следовательно, наш коэффициент пересчета:
7 9 Что дает? Зачем нужны два коэффициента преобразования? Мы не знаем.
