Получение стекла реакция: Запишите формулу стекла и уравнения реакции его получения
Органическое стекло — получение и свойства полиметилметакрилата. Свойства оргстекла | ПластЭксперт
Оргстекло
Что из себя представляет оргстекло
Оргстекло – это бытовое название листовых материалов, напоминающих по виду и некоторым свойствам оконное стекло, и состоящее из прозрачных полимеров: полиакрилатов, поликарбонатов, полистиролов, различных сополимеров. Чаще всего так называют полиметилметакрилат (ПММА), который представляет из себя полимер, элементарным звеном которого служит метилметакрилат. В дальнейшем мы будем рассматривать под названием «оргстекло» в основном именно ПММА. Ниже приведена химическая формула полиметилметакрилата:
Рис.1.
Обычно ПММА – это прозрачный полимер, который довольно легко поддается переработке в изделия всеми основными промышленными методами. Из-за своей высокой прозрачности он и получил второе название «органическое стекло».
Производство ПММА
На современных нефтехимических предприятиях полиметилметакрилат синтезируют путем полимеризации по свободно-радикальному механизму. Реакцию проводят в блоке или суспензии, иногда в эмульсии или растворе. Выпускают оргстекло обычно в форме гранул для дальнейшей переработки или листов.
Рассмотрим подробнее технологический процесс получения ПММА. Химическая реакция проводится в формах, состоящих из стальных, алюминиевых листов или слоев силикатного стекла. Прокладки из эластичного материала, от расстояния между которыми зависит толщина будущего листа органического стекла, устанавливают в указанные формы. На этом подготовительные операции завершаются.
Первой технологической операцией в ходе синтеза является получение форполимера – сиропообразной жидкости с высокой степенью вязкости. После получения форполимер помещают в форму, которую располагают в камере с нагретой водой или оборотным теплым воздухом. Процесс ведется через форполимер для недопущения появления дефектов из-за высокой усадки при полимеризации метилметакрилата, которая достигает 23 процентов. Добавки, необходимые для придания материалу необходимых свойств, например красители, замутнители, пластификаторы, стабилизаторы и т.д. диспергируют в форполимере перед полимеризацией. После окончания процесса синтеза листы оргстекла вынимают из форм и проводят их финишную обработку, которая заключается в удалении облоя и при необходимости шлифовке и полировке.
Процесс ведется через форполимер для недопущения появления дефектов из-за высокой усадки при полимеризации метилметакрилата, которая достигает 23 процентов. Добавки, необходимые для придания материалу необходимых свойств, например красители, замутнители, пластификаторы, стабилизаторы и т.д. диспергируют в форполимере перед полимеризацией. После окончания процесса синтеза листы оргстекла вынимают из форм и проводят их финишную обработку, которая заключается в удалении облоя и при необходимости шлифовке и полировке.
Кроме описанного выше литьевого метода органическое стекло также изготавливают методом экструзии. Существует ряд отличий между получаемым экструзионным оргстеклом и литьевым. Экструзионный акрил характеризуется менее прочными молекулярными связями, тогда как в литом акриле они более прочные. Прочные связи между молекулами придают литьевому оргстеклу более высокие физико-механические, тепловые и химические характеристики. Также особенности производства материала влияют на дальнейшее его поведение при обработке и переработке в изделия.
Полиметилметакрилат производят в различных уголках мира под различными торговыми марками. В зависимости от фирмы и страны производителя ПММА пожет иметь следующие названия: плексиглас, люсайт, плексигум , диакон, ведрил, акрима, карбогласс, новаттро, плексима, лимакрил, плазкрил, акрилекс, акрилайт, акрипласт, акрил, метаплекс и др. Возвращаясь к методам получения оргстекла заметим, что экструзия – крупнотоннажный процесс, который потребляет большого объем полимерного сырья, и применяется только на больших производствах. С этим связан тот факт, что количество цветов и ассортимент свойств марок экструзионного материала обычно гораздо скромнее, чем предлагается на рынке литьевого акрила.
Органическое стекло любого типа можно вторично перерабатывать без особых ограничений, как любой стандартный термопластичный материал.
Основные свойства оргстекла
ПММА, как и любой полимер, обладает высокой молекулярной массой, она для этого полимера достигает 2 млн атомных единиц. Температура размягчения ПММА чуть выше 120 градусов Цельсия, а температура плавления порядка 160 градусов, что во многом обусловливает его хорошую перерабатываемость.
Температура размягчения ПММА чуть выше 120 градусов Цельсия, а температура плавления порядка 160 градусов, что во многом обусловливает его хорошую перерабатываемость.
По физическим характеристикам оргстекло обладает очень хорошей прозрачностью, высокой проницаемостью не только для лучей видимой части спектра, но и для ультрафиолета. Органическое стекло имеет хорошие диэлектрические и физико-механические данные и обладает высокой атмосферостойкостью. Также этот материал достаточно химически стоек: устойчив к неконцентрированным кислотам и щелочам, спиртам и жирам, а также к гидролизу и минеральным маслам. Оргстекло, насколько это известно современной науке, безвредно для живых организмов и в то же время стойко к биологическому разрушению. Полиметилметакрилат перерабатывается экструзией с последующим термоформованием (вакуумным или пневмоформованием), штамповкой, литьем под давлением на термопластавтоматах. Также оргстекло легко обрабатывается механически, склеивается и сваривается.
Рассмотрим особенности материала более подробно.
Плотность ПММА для полимера достаточно высока и составляет 1190 кг/см3 , что намного ниже (почти в 2,5 раза) чем плотность силикатного стекла. Она примерно на 20% выше плотности ПЭНД и на 30% полипропилена, но, например, на 17% меньше плотности жесткого ПВХ. Низкая плотность приводит к тому, что при одинаковой толщине масса конструкции из органического стекла в 2,5 раза меньше, чем такая же из силикатного стекла. Зачастую такая конструкция требует гораздо меньше несущих элементов и опор, что придает ей гораздо лучших эстетических вид. Ударная прочность оргстекла примерно в 5 раз выше прочности силикатного стекла, что дает различные возможности его применения там, где высок риск для хрупкого обычного стекла.
Широко известно, что органическое стекло является легковоспламеняющимся, однако оно менее опасно, чем другие полимеры, подверженные открытому горению. В процессе горения ПММА выделяет минимум вредных продуктов окисления. Температура его воспламенения составляет 260°С.
В процессе горения ПММА выделяет минимум вредных продуктов окисления. Температура его воспламенения составляет 260°С.
Оргстекло, в отличие от некоторых полимеров имеет высокую морозостойкость. Диапазон рабочих температур ПММА довольно широк и находится в промежутке между минус 40°С и +80°С.
Оргстекло обладает малой теплопроводность, около 0,2—0,3 Вт/(м·К), что гораздо ниже теплопроводности обычного силикатного стекла от 0,7 до 13,5 Вт/(м·К), что дает органическому материалу большое преимущество при применении в энергоэффективных объектах.
Оргстекло обладает высокой стойкостью к старению. Т.к. светопропускание этого материала больше, чем у любого крупнотоннажного полимера и равно примерно 92% от проходящего через него видимого света. Органическое стекло не нуждается в дополнительной защите ультрафиолетового излучения. Физико-механические свойства ПММА, и его светопропускание очень медленно изменяется со временем, несмотря на действие УФ-лучей и воздействий атмосферных явлений. Однако для окрашенного оргстекла возможно изменение цвета материала в зависимости от его производителя и определенного цвета, но это, как правило, происходит по истечении большого срока и при эксплуатации вне помещений.
Однако для окрашенного оргстекла возможно изменение цвета материала в зависимости от его производителя и определенного цвета, но это, как правило, происходит по истечении большого срока и при эксплуатации вне помещений.
При этом оргстекло достаточно склонно к поверхностным повреждениям, оно довольно легко царапается. Это обусловливает применение специальных защитных пленок из полимеров на поверхности стекла.
Химические и экологические характеристики
Оргстекло является достаточно экологичным материалом. Оно не выделяет вредных химических соединений не только при горении, но и при обычном многолетнем применении и считается абсолютно безопасным материалом. Его использование разрешено как вне помещений, так и внутри них, в том числе в лечебных и детских заведениях. Как упоминалось ранее, отходы органического стекла не токсичны и могут полностью быть переработаны вторично.
ПММА известен своей высокой стойкостью к воде, а также к различным химическим соединениям, например к щелочам, растворам солей. Из распространенных химикатов на оргстекло существенно влияют концентрированные серная, хромовая и азотная кислота и некоторые растворы сильных кислот: цианистоводородные (синильная кислота) и фтористоводородные (плавиковая кислота).
Из распространенных химикатов на оргстекло существенно влияют концентрированные серная, хромовая и азотная кислота и некоторые растворы сильных кислот: цианистоводородные (синильная кислота) и фтористоводородные (плавиковая кислота).
Кроме того, органическое стекло можно растворить в некоторых сильных растворителях: дихлорэтане и других хлорированных углеводородах, сложных эфирах, альдегидах и кетонах. Также на него могут воздействовать низкомолекулярные спирты, в том числе этиловый спирт. Однако, реакция при этом медленная. Так при недолгом воздействии на оргстекло разбавленного до 10 процентов этилового спирта видимых изменений не происходит.
Применение оргстекла
Органическое стекло применяется достаточно широко. Высокая транспарентность в сочетании с хорошими механическими характеристиками открыла этому материалу дорогу к использованию в области транспорта: авиационной технике, автомобильной отрасли и т. п. Широко применяется ПММА в светотехнической индустрии, как листовой материал, прошедший полировку, так и гранулы для литья под давлением или экструзии рассеивателей светильников.
п. Широко применяется ПММА в светотехнической индустрии, как листовой материал, прошедший полировку, так и гранулы для литья под давлением или экструзии рассеивателей светильников.
Рис.2. Фара мотоцикла
Кроме того, оргстекло используют в архитектуре и строительной индустрии, изготовлении товаров для дома, приборостроении и т.д. Широко применяется в сельском хозяйстве как материал для остекления оранжерей и теплиц. Оргстекло – хороший конструкционный материал для применения в строительстве, например для производства окон и дверей, веранд и для отделочных работ и некоторых изделий. В приборостроении оргстекло используют в качестве компонентов инструментов и приборов. В медицине оно применяется также в области инструментов, изготовлении контактных линз и в протезировании. В области оптики из этого чудесного материала выпускают линзы и призмы. Также из оргстекла можно делать компоненты микроэлектроники, игры и игрушки для детей, средства индивидуальной защиты (очки, маски), трубы и трубки для пищевой индустрии, разнообразные изделия для спортивного снаряжения и многое другое.
Незаменимо органическое стекло для уличного применения, им покрывают рекламные щиты, вывески, световые короба и прочие наружные носители информации и рекламы. Повсеместно мы видим этот материал при оформлении и наполнении витрин, в витражах, защитном остеклении, дизайнерских изделиях, сантехнике, музыкальных инструментах, торговых материалах, например ценникодержателях, POS-материалах, аквариумах, сувенирах и т.д.
Также в материалах последних поколений, особенно в авиа- и вертолетостроении, оргстекло активно применяется в составе многослойных композитных материалов, в том числе в комбинации с неорганическими стеклами.
История оргстекла
Этому материалу уже почти 100 лет. Оргстекло, которое в то время получило название «плексиглаз» (марка Plexiglas существует и сегодня) было получено в 1928 году немецким специалистом Отто Рёмом. Товарное производство материала началось в 1933 году там же в Германии, а первые известные продукты, для получения которых было применено оргстекло, датированы 1936 годом.
Рис.3. Кабина самолета середины 20 века
Такой материал, как прозрачный прочный полимер пришелся очень вовремя. В 20-30-е годы 20 века многие страны совершили скачок в развитии самолетостроения, особенно военного, в целом страны милитаризировались. В эти годы появились первые самолеты с закрытой кабиной, для изготовления которой отлично подошел новый полимер. Оргстекло было безопасным, то есть не разбивалось с образованием осколков, оптически прозрачным, химически стойким, в том числе к бензину, маслам и смазкам, водостойким. Всё это определило быстрый рост потребления материала.
40-е годы прошли под знаком развития применения оргстекла в авиастроении и не только. В годы ВОВ из него изготавливались кабины и другие части военных самолетов, детали подводных лодок и другие элементы, требующие прозрачности, легкости и прочности. С началом использования других, более продвинутых и менее горючих материалов, в том числе композитов, применение оргстекла в военной отрасли отошло на второй план.
В послевоенные годы органическое стекло получило широчайшее распространение во всех описанных выше областях. В настоящее время ПММА применяется гораздо скоромнее других крупнотоннажных полимеров, но в качестве прозрачного пластика он по-прежнему очень популярен. Однако во многом этот полимер потеснили другие транспарентные пластики, в том числе с лучшими свойствами или более дешевые, например поликарбонат, некоторые марки ПВХ и особенно полистирол и его сополимеры. Последние обладают огромным разнообразием характеристик при невысокой цене.
Химия варки древних стекол на зольной шихте
Стекловарение — сложный процесс, состоящий из ряда физических, химических и химико-физических явлений. Трудность варки зольной шихты зависит от веществ, входящих в ее состав, так как вещества имеют различную реакционную способность с кремнеземом — главной частью кварцевого песка.
Она не равноценна простому явлению плавления, как, например, плавление металлов или солей. Поваренная соль плавится и переходит из твердого агрегатного состояния в жидкое при 801°C, а, к примеру, медь — при 1083°C. Такое явление свойственно для простых в физическом смысле веществ.
Поваренная соль плавится и переходит из твердого агрегатного состояния в жидкое при 801°C, а, к примеру, медь — при 1083°C. Такое явление свойственно для простых в физическом смысле веществ.
Шихта — сложное вещество, смесь простых веществ, и ее переход из одного агрегатного состояния не равносилен явлению плавления металлов или солей [3]. Она содержит различные химические соединения с отличными друг от друга температурами плавления. Рассмотрим в качестве примера шихту, состоящую из песка (кремнезема, SiO2), карбоната кальция или мела (CaCO3) и карбоната натрия или соды (Na2CO3), и сравним температуры плавления веществ, входящих в ее состав (табл. 1).
Таблица 1
Температуры плавления веществ, входящих всостав шихты
Название вещества | Формула | Температура плавления, °С |
Диоксид кремния(кремнезем) | SiO2 | 1713 |
Карбонат кальция(мел) | CaCO3 | 900 * |
Карбонат натрия (сода) | Na2CO3 | 851 |
*температура диссоциации,
Температуры плавления имеют довольно большие различия. Если бы весь процесс варки стекла сводился к плавлению составных частей, то было бы необходимо нагревать шихту до 1713°С, для получения из нее расплавленного стекла. В действительности же стекло при варке в современных печах имеет температуру 1450–1470°С, а в древности — 1050–1100°С. Именно благодаря совокупности различных явлений кроме плавления, можно получить стекло из смеси разнородных веществ, входящих в состав шихты. Важнейшим из явлений является взаимодействие между компонентами. Оно начинается еще при низких температурах, когда вещества находятся в твердом состоянии. Так, к примеру, реакция в твердом состоянии между кремнеземом (SiO2) и карбонатом натрия (Na2CO3), начинает протекать при достижении температуры 300°С, то есть задолго до их плавления. Позже, когда одно из веществ расплавится, скорость реакции значительно возрастает. Наиболее энергично реакция между SiO2 иNa2CO3 идет при 720–900°С, по уравнению
Если бы весь процесс варки стекла сводился к плавлению составных частей, то было бы необходимо нагревать шихту до 1713°С, для получения из нее расплавленного стекла. В действительности же стекло при варке в современных печах имеет температуру 1450–1470°С, а в древности — 1050–1100°С. Именно благодаря совокупности различных явлений кроме плавления, можно получить стекло из смеси разнородных веществ, входящих в состав шихты. Важнейшим из явлений является взаимодействие между компонентами. Оно начинается еще при низких температурах, когда вещества находятся в твердом состоянии. Так, к примеру, реакция в твердом состоянии между кремнеземом (SiO2) и карбонатом натрия (Na2CO3), начинает протекать при достижении температуры 300°С, то есть задолго до их плавления. Позже, когда одно из веществ расплавится, скорость реакции значительно возрастает. Наиболее энергично реакция между SiO2 иNa2CO3 идет при 720–900°С, по уравнению
Na2CO3 + SiO2 = Na2SiO3 + CO2.
На практике реакция завершается еще быстрее благодаря присутствию в шихте карбоната кальция (CaCO3).
Реакционная способность различна у каждой пары веществ и зависит в большей степени от температуры, как правило, при ее повышении увеличивается скорость реакции. Но имеются вещества, которые не реагируют между собой. Для стеклоделия архиважно знать, в каких взаимоотношениях между собой находятся компоненты шихты и, в первую очередь, как они реагируют с песком.
При варке стекла наиболее энергично реагируют с кремнеземом карбонаты натрия и калия. То же самое нельзя сказать о сульфатах и особенно хлоридах — их взаимодействие с кремнеземом зависит от особых условий. Хлористый натрий (NaCl, поваренная соль) реагирует с SiO2 лишь в присутствии паров воды, еле заметно — при 600°С и очень слабо — при 1000°С по уравнению
SiO2 + 2NaCl +H2O = Na2SiO3 + 2HCl.
В результате реакции образуется силикат натрия — простейшее силикатное стекло.
Так как в стекловаренной печи не может существовать влажная среда, то хлористый натрия нельзя рассматривать как компонент шихты, с которым кремнезем мог бы образовывать стекло. Но поваренная соль имеет другую особенность, ценную для стеклоделия: она плавится при сравнительно низкой температуре — 801°С. Еще Д. И. Менделеев подчеркивал, что «поваренная соль легко плавится, оттого она, будучи примешена к массе делает ее жидкою при слабом жаре».
Кроме того, хлорид натрия способен образовывать с карбонатом натрия так называемую «эвтектику», легкоплавкую смесь, плавящуюся при более низкой температуре, чем каждый из компонентов в отдельности. Температура образования эвтектики 638°С, что на 217°С ниже, чем плавление карбоната натрия (см. табл. 1) — основного компонента шихты. Значение эвтектики заключается в образовании в шихте жидкого вещества, ускоряющего процесс варки. Однако, содержание хлористого натрия в шихте должно быть не более 1,5–2,0 %. Экспериментальные исследования [1] и проверка в производственных условиях показали, что в этих количествах он играет положительную роль, в противном случае затрудняется процесс образования гомогенного стекла. На русских стекольных заводах в начале XIX века к шихте намеренно добавляли 2 % поваренной соли.
На русских стекольных заводах в начале XIX века к шихте намеренно добавляли 2 % поваренной соли.
С. Линдрот изучая процессы варки стекла при помощи радиоактивных изотопов показал, что NaCl снижает температуру плавления шихты стекла Na2O — CaO — SiO2 на 100°С [4].
В случае избытка хлористого натрия в стекольной смеси он всплывает из нее при варке наверх в виде жидкого расплавленного слоя, который не смешивается с расплавом стекла в однородную массу и плавает над ним, как масло в воде. Если вязкость расплава слишком велика, то поваренная соль остается в нем в виде комочков, не смешиваясь с ним и препятствуя образованию гомогенного стекла. Растворимость хлористого натрия в стекла очень ограничена — 2,34 % для стекол промышленного типа. В египетских стеклах максимальное обнаруженное содержание хлора — 1,17 %, что соответствует 1,93 % NaCl, а в римских стеклах из Заальбурга — 1,18 % или 1,95 % NaCl [2].
Сернокислый натрий (Na2SO4) не реагирует непосредственно с кремнеземом. Если добавить к шихте уголь по строгой пропорции и вести варку в восстановительной среде, то образующийся в ходе реакции сернокислый натрий вступает во взаимодействие с кремнеземом и образует простейшее стекло — силикат натрия.
Если добавить к шихте уголь по строгой пропорции и вести варку в восстановительной среде, то образующийся в ходе реакции сернокислый натрий вступает во взаимодействие с кремнеземом и образует простейшее стекло — силикат натрия.
Na2SO4 + C = Na2SO3 + CO
Na2SO3 + SiO2 = Na2SiO3 +SO2
Na2SO4 + SiO2 + C = Na2SiO3 + CO + SO2
Чтобы реакция протекала согласно уравнению, необходимо знать, какое количество угля (С) надо взять. Для этого, в свою очередь, надо знать, сколько сульфата натрия содержится в шихте. При избытке угля стекло может окраситься в желто-коричневый или черный цвет. В случае избытка сульфат натрия расплавится (884°С) и выплывет поверх расплавленного стекла, аналогично с хлористым натрием. В стекле он имеет ограниченную растворимость и не образует с ним однородного вещества: происходит «ликвация» — расслоение на две фазы в жидком состоянии. Наибольшее содержание серного ангидрида в германских средневековых стеклах — 0,56 %, в среднеазиатских средневековых стеклах — в пределах от 0,02 до 0,96 %.
В стекле он имеет ограниченную растворимость и не образует с ним однородного вещества: происходит «ликвация» — расслоение на две фазы в жидком состоянии. Наибольшее содержание серного ангидрида в германских средневековых стеклах — 0,56 %, в среднеазиатских средневековых стеклах — в пределах от 0,02 до 0,96 %.
Как упоминалось ранее, зола состоит из углекислых, сернокислых и хлористых солей. Не всякая зола хороша для варки стекла, даже если она содержит много щелочных солей. Для стекловарения ценна зола с углекислыми солями щелочных металлов, а содержание сульфатов и хлоридов должно быть строго ограничено.
Египетские стекловары с древнейших времен располагали материалами, содержащими много вредных солей, затруднявшими варку стекла. Сода из египетских озер Вади Натрун, найденная в могилах периода XVIII династии, содержит 0,5–39,5 % хлористого натрия и 5,5–27,8 % сернокислого натрия. Современная сода из тех же источников имеет 22,0–26,8 % NaCl и 2,3–29,9 % Na2SO4. Углекислого натрия в древних образцах этой соды 15,5–94,0 % и современных 22,4–75,0 % [5].
Углекислого натрия в древних образцах этой соды 15,5–94,0 % и современных 22,4–75,0 % [5].
Именно такие компоненты и привели к особому процессу варки стекла, возникшего еще в глубокой древности. Речь идет о получении стекла с предварительным спеканием шихты, применявшимся до XIX в., то есть около трех с половиной тысяч лет.
Флиндерс Петри, обнаруживший при раскопках в Тель-эль-Амарне стеклодельную мастерскую с остатками печей, фрагментов тиглей для сплавки стекла и много стеклянного брака, относящихся к 1370 г. до н. э., высказал предположение, что плавка стекла состояла из двух стадий. Сначала шихта спекалась в плоских и широких чашах, а затем производилась окончательная плавка в высоких и узких тиглях. Шихту составляли из нильского песка и природной соды. В результате первой стадии процесса щелочные карбонаты вместе с кремнеземом песка образовывали стекловидную «фритту» (спеченную массу), к которой также присоединялись карбонаты кальция и магния; сульфаты и хлориды оставались отдельно в виде сплавившихся кусочков или прослоек «пены», не вступая во взаимодействие со стекловидной фриттой. Последнюю по окончании стадии фриттования, вероятней всего, отделяли от сульфатно-хлоридной пены и переносили в узкие тигли для дальнейшей плавки. В последующем процессе стекловарения пена не принимала участия.
Последнюю по окончании стадии фриттования, вероятней всего, отделяли от сульфатно-хлоридной пены и переносили в узкие тигли для дальнейшей плавки. В последующем процессе стекловарения пена не принимала участия.
Согласно Плинию, процесс варки состоял из трех этапов — первые два заключались во фриттовании шихты, а в течение третьего вели плавку освобожденной от «пены» стекловидной фритты [1].
В Х веке Теофил описывает процесс спекания в IV главе своего трактата: «Возьми две части золы и одну часть песка, очищенную водой от земли и камней, и смешай в чистом месте. После хорошего и долгого перемешивания возьми ее железной лопатой и насыпь в верхний под в малое отделение печи для подогревания. Когда она начинает делаться горячей, надо ее переворачивать, чтобы она не была жидкой, но лишь спеклась. Так продолжается ночь и один день [4].
Теофил подчеркивает, что смысл этой стадии варки стекла заключается только в том, чтобы шихта спеклась, но не стала жидкой. С точки зрения технологии это целесообразно и понятно. Если допустить сплавление стекловидной фритты и хальмозы, то отделение последней было бы очень затруднительно, или почти невозможно, а попытаться плавить все вместе было бы бесполезно, так как получить гомогенное стекло из такой смеси нельзя. Существуют предположения, что, если не вести предварительное фриттование, то зола начнет плавиться раньше, и тяжелые зерна песка будут погружаться на дно горшка. Но главный смысл фриттования не в этом.
Если допустить сплавление стекловидной фритты и хальмозы, то отделение последней было бы очень затруднительно, или почти невозможно, а попытаться плавить все вместе было бы бесполезно, так как получить гомогенное стекло из такой смеси нельзя. Существуют предположения, что, если не вести предварительное фриттование, то зола начнет плавиться раньше, и тяжелые зерна песка будут погружаться на дно горшка. Но главный смысл фриттования не в этом.
Постоянное перемешивание лопатой шихты способствовало передвижению новых частиц и соприкосновению их с пламенем, что облегчало равномерное спекание.
На основании физико-химических соображений, основанных на изучении реакций, считалось, что температура фриттования была не больше 750°С [2]. Согласно разным источникам, температура варки стекла в средние века была не выше 1200°С.
Английские стеклоделы в XIX веке изготавливали стекло в два приема: сначала получали фритту, а затем плавили ее до стеклообразного состояния [6]. Смесь из 18 частей сухого и молотого ирландского кельпа (золы водорослей), 13 частей сухого песка и 1 части сеяной извести перемешивали и обжигали в течение 2 часов на таком жару, чтобы она не «растопилась»; затем усиливали огонь, чтобы смесь «слилась в тесто» и оставляли ее в таком состоянии 3–4 часа, беспрестанно помешивая эту густую массу. Потом ее вынимали из печи и пока он еще не окрепла, придавали форму длинных четырехугольных пластов, называемых «фриттами». Их редко сразу употребляли в дело, чаще всего сваливали в кучу и хранили до употребления. Было установлено, чем старее фритты, тем они лучше. Богатые заводчики имели большие запасы их и употребляли не раньше, чем через год.
Потом ее вынимали из печи и пока он еще не окрепла, придавали форму длинных четырехугольных пластов, называемых «фриттами». Их редко сразу употребляли в дело, чаще всего сваливали в кучу и хранили до употребления. Было установлено, чем старее фритты, тем они лучше. Богатые заводчики имели большие запасы их и употребляли не раньше, чем через год.
Это краткое описание, заимствованное из английской практики стекловарения XIX века, весьма ценно и проливает свет на смысл двухступенчатой варки стекла. Вместо того, чтобы отбирать, сортировать спекшуюся массу на ценные куски стекловидного вещества и отходы в виде пены, состоящие из сульфатов и хлоридов, этот процесс заменен долгим вылеживанием. Сульфаты и хлориды как растворимые в воде части, постепенно извлекаются из фритт за счет атмосферной влаги и удаляются, а стекловидная часть их остается и используется далее для варки стекла.
Литература:
- Безбородов М. А. Стеклоделие в Древней Руси. Минск, Изд-во АН БССР, 1956;
- Безбородов М.
 А. Химия и технология древних и средневековых стекол. Минск, Изд-во АН БССР, 1969;
А. Химия и технология древних и средневековых стекол. Минск, Изд-во АН БССР, 1969; - Иебсен-Марведель И. Варка и формовка стекла. Перевод В. Г. Воано. М. — Л., 1932;
- Качалов Н. Н. Стекло. М. Издательство АН СССР, 1959;
- Лукас А. Материалы и ремесленные производства древнего Египта. М., 1958;
- О стекле. Журнал мануфактур и торговли, № 5, стр. 13–45 и № 6, стр 3–33, С. Петербург, 1825 г. (Перевод статье Парьерсе из журнала «ChemicalEssays».
Основные термины (генерируются автоматически): поваренная соль, хлористый натрий, карбонат натрия, стекло, шихта, вещество, гомогенное стекло, карбонат кальция, сернокислый натрий, стекловидная фритта.
Как слабая кислота может растворить стекло? Учебное пособие
Инструменты для творчества скоро появятся, чтобы вдохновить!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Химия
Общая химия
Кислоты и основания
Как слабая кислота может растворять стекло? Учебное пособие
Gayathri Mani
Стеклянный контейнер может агрессивно реагировать с плавиковой кислотой, но, как правило, он инертен или не реагирует с большинством кислот.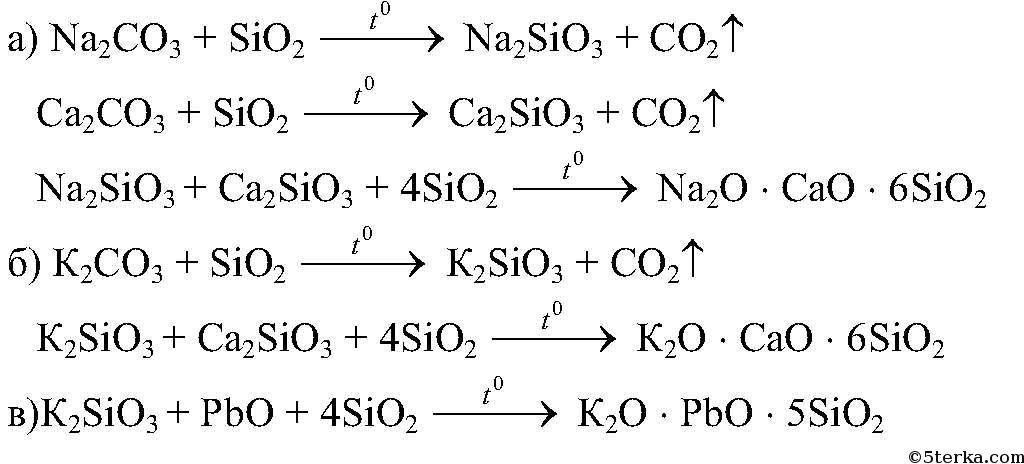
Содержание
ВВЕДЕНИЕ:
Вы, должно быть, сталкивались с таким искусством на куске стекла в своей повседневной жизни. Вы когда-нибудь задумывались, как были созданы эти конструкции? Пользователь делает эти рисунки на стекле с помощью процесса, называемого «травлением стекла». Способы создания произведений искусства на поверхности стекла с использованием кислотных, едких или абразивных химикатов называются травлением стекла. Шероховатая поверхность и прозрачный вид матового стекла вызваны потерей мельчайших кусочков стекла. Однако этого можно достичь только с помощью нескольких очень специфических химических веществ, поскольку стекло инертно по отношению к большинству химических веществ. Одним из таких химических веществ является плавиковая кислота, которая является слабой кислотой.
Источник
Хотите знать, что такое слабая кислота? Слабая кислота – это кислота, которая частично диссоциирует на составляющие ее ионы в водном растворе или воде. При этом давайте вернемся к нашей теме и обсудим инертность стекла по отношению к большинству химических веществ.
При этом давайте вернемся к нашей теме и обсудим инертность стекла по отношению к большинству химических веществ.
ИНЕРТНОСТЬ СТЕКЛА
Стекло может растворяться кислотой. Только некоторые кислоты, в основном содержащие фтор, обладают достаточной коррозионной активностью, чтобы адекватно растворять стекло. Соляная кислота не реагирует со стеклом.
ПОЧЕМУ БОЛЬШИНСТВО КИСЛОТ НЕ ВЛИЯЕТ НА СТЕКЛО?
Поскольку стекло очень устойчиво к большинству кислот, оно обычно используется для хранения кислот. Но почему большинство кислот не действуют на стекло?
Поскольку стекло имеет чрезвычайно прочную и стабильную атомную структуру, на него не действует кислота. Из-за сильных химических связей наиболее распространенный компонент стекла, диоксид кремния, является нереакционноспособным веществом, что делает стекло очень устойчивым к большинству кислот.
Растворение стекла (или любого другого материала в этом отношении) по существу представляет собой разрыв химических связей на атомном уровне. За исключением фторсодержащих кислот, большинство кислот недостаточно агрессивны для этого.
За исключением фторсодержащих кислот, большинство кислот недостаточно агрессивны для этого.
КАК КИСЛОТЫ НА ОСНОВЕ ФТОРА СПОСОБНЫ РАСТВОРЯТЬ СТЕКЛО?
Поскольку фтор имеет сильное свойство притягивать к себе электроны, кислоты, содержащие фтор, могут вызывать эрозию стекла (электроотрицательность).
Когда кислота на основе фтора, такая как плавиковая кислота, вступает в контакт со стеклом (диоксидом кремния), атом фтора притягивает к себе электроны, разрывая связь между кремнием и кислородом и растворяя стекло.
ПРОЧИЕ ПРИМЕНЕНИЯ ФТОРИСТОЙ КИСЛОТЫ
Плавиковая кислота имеет широкий спектр применения. Его можно использовать для удаления ржавчины с предметов белья. Очистка алюминия, гальваническое покрытие, подготовка поверхности для процессов производства кремния в электронике и даже в качестве реагента при синтезе широкого спектра органических соединений, содержащих фтор, — все это основные промышленные применения (например, тефлон).
Источник
На слое тефлона, который обычно используется для покрытия посуды с антипригарным покрытием, пролитое вино образует «пузыри», как видно на изображении выше.
ВЫВОД:
- Стекло может растворяться кислотой. Только некоторые кислоты, в основном содержащие фтор, обладают достаточной коррозионной активностью, чтобы адекватно растворять стекло.
- Процесс растворения стекла известен как травление стекла.
Часто задаваемые вопросы:
1. Существует ли кислота, растворяющая стекло?
Плавиковая кислота является предшественником практически всех соединений фтора и представляет собой раствор фтористого водорода (HF) в воде. Это бесцветный, чрезвычайно агрессивный раствор, способный растворять широкий спектр материалов и стекла.
2. Что растворяет стекло?
Мы дезинтегрируем стекло с помощью гидроксида натрия (очиститель канализации). Поскольку стекло почти непроницаемо для химикатов, оно является предпочтительным материалом для химических контейнеров и реакционных сосудов. С другой стороны, стекло растворяется при контакте с расплавленным гидроксидом натрия.
3. Что растворяет соляная кислота?
Соляная кислота используется для растворения различных металлов, оксидов металлов и карбонатов металлов, аналогично тому, как она используется для травления.
4. Может ли соляная кислота плавить пластик?
Пластмассы вообще плохо реагируют с кислотами, а кислотостойкие пластмассы чрезвычайно устойчивы. В результате соляная кислота не способна растворить пластик.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Может ли соляная кислота растворять стекло ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности — мы обещаем, это делает учебу намного веселее! 😎
ИСТОЧНИКИ:
- Использование плавиковой кислоты. https://www.ck12.
 org/c/chemistry/acid/rwa/How-Can-A-Weak-Acid-Dissolve-Glass/. По состоянию на 26 января 2022 г.
org/c/chemistry/acid/rwa/How-Can-A-Weak-Acid-Dissolve-Glass/. По состоянию на 26 января 2022 г. - Травление стекла. https://profoundphysics.com/can-acid-dissolve-glass/. По состоянию на 26 января 2022 г.
- Инертность стекла. https://www.britannica.com/science/водород-фторид. По состоянию на 26 января 2022 г.
Может ли кислота растворять стекло? Объяснение науки – Углубленная физика
Кислоты, особенно сильные, могут растворять множество различных веществ и материалов. Стекло, однако, не растворяется большинством веществ, но может ли кислота растворить его?
Короче говоря, кислота может растворять стекло. Однако лишь некоторые кислоты, в основном кислоты, содержащие элемент фтор, обладают достаточной коррозионной активностью, чтобы должным образом растворять стекло. Примером этого является фтористоводородная кислота, которая способна вступать в реакцию с диоксидом кремния, содержащимся в стекле, растворяя его.
Однако большинство других кислот практически не действуют на стекло. Лишь немногие кислоты действительно соответствуют химическим требованиям для растворения стекла.
Лишь немногие кислоты действительно соответствуют химическим требованиям для растворения стекла.
Содержание
Toggle
Какие кислоты могут растворять стекло?
Только определенные виды кислот действительно способны растворять стекло, но какие именно?
Обычно растворяют стекло кислоты, содержащие фтор. Это связано с химической способностью фтора разрушать связи диоксида кремния, обнаруженные в стекле. Примерами кислот, которые могут растворять стекло, являются фтористоводородная кислота, фтористоводородная кислота и фторантимоновая кислота.
Ниже приведена таблица кислот, способных растворять стекло , а также их химические формулы:
| Кислота, способная растворять стекло | Химическая формула | Плавиковая кислота | HF |
|---|---|
| Фторантимоновая кислота (суперкислота) | H 2 FSbF 6 |
| Пятифторид сурьмы | SbF 5 9 0143 |
| Фторсерная кислота | HSO 3 F |
| Борнофтористая кислота | HBF 4 |
Таблица кислот, способных растворять стекло.
Далее в статье вы найдете дополнительную информацию о том, как эти конкретные кислоты реагируют со стеклом и способны растворять его.
Почему на стекло не действует большинство кислот?
Стекло является распространенным материалом, используемым для хранения кислот, поскольку оно обладает высокой устойчивостью к большинству кислот. Но почему именно на стекло не действует большинство кислот?
Кислота не действует на стекло, так как оно имеет очень прочную и стабильную атомную структуру. Это связано с тем, что наиболее распространенный материал в стекле, диоксид кремния, является особенно нереактивным веществом из-за его сильных химических связей, что делает стекло очень устойчивым к большинству кислот.
Чтобы стекло чем-то растворялось, должна была произойти химическая реакция .
Растворение стекла (или любого другого твердого вещества в этом отношении) на самом деле просто означает разрыв химических связей на атомном уровне.
В настоящее время наиболее распространенным материалом, из которого изготавливается большинство стекол, является диоксид кремния или диоксид кремния , который имеет химическую формулу SiO 2 . Это молекула, состоящая из атома кремния и двух атомов кислорода.
Химическая связь между атомом кремния и атомами кислорода достаточно прочная, а это означает, что ее нелегко разорвать. Это, с другой стороны, означает, что стекло , как правило, достаточно устойчиво к большинству кислот .
Применительно к стеклу и кислоте, диоксид кремния, из которого изготовлено стекло должен вступить в реакцию с соединениями, содержащимися в кислоте , чтобы стекло растворилось.
Большинство кислот на самом деле недостаточно агрессивны для этого, за исключением тех, которые содержат фтор .
Типичным реальным примером этого является серная кислота, которая обычно хранится в стеклянных контейнерах.
Серная кислота, H 2 SO 4 , не способна растворять стекло, поэтому ее можно безопасно хранить в стеклянной таре. Это связано с тем, что серная кислота просто недостаточно агрессивна, чтобы разъедать чрезвычайно сильный диоксид кремния (SiO 2 ) соединения, которые являются основным компонентом стекла.
Почему кислоты на основе фтора способны растворять стекло?
Почти единственные кислоты, способные растворять стекло (вступать в реакцию с диоксидом кремния), это те, которые содержат элемент фтор .
Причина, по которой кислоты, содержащие фтор, могут растворять стекло, заключается в том, что фтор обладает очень сильной способностью притягивать к себе электроны (таким образом создаются химические связи, «делясь» электронами между двумя атомами).
Эта способность называется электроотрицательностью и, по сути, является показателем того, насколько легко будут реагировать два атома.
Чем больше разница электроотрицательностей между двумя атомами, тем сильнее один из атомов будет притягивать к себе электроны и тем легче будет образоваться химическая связь между ними.
Ниже приведена таблица некоторых значений электроотрицательности различных элементов. Чтобы получить разницу электроотрицательностей между двумя элементами, просто возьмите большее значение минус меньшее значение .
| Элемент | Электроотрицательность |
|---|---|
| Кремний (Si) | 1,9 |
| 3,4 | |
| Водород (H) | 2,2 |
| Хлор (Cl ) | 3,2 |
| Фтор (F) | 4,0 |
Источник: PubChem
Из этой таблицы видно, что фтор и кремний имеют большую разницу электроотрицательностей (4,0 – 1,9 = 2,1) , чем кремний и кислород (3,4 – 1,9 = 1,5).
Теперь это означает, что когда кислота на основе фтора вступает в контакт со стеклом (диоксидом кремния), атом фтора сильнее притягивает к себе электроны и, таким образом, связь между кремнием и кислородом разрывается и стекло растворяется .
Большая разница в электроотрицательности между фтором и кремнием является причиной того, что только кислоты на основе фтора могут растворять стекло, а что-то вроде соляной кислоты не может, хотя это очень сильная кислота.
По этой причине большинство чрезвычайно сильных кислот можно безопасно хранить в стеклянной бутылке или контейнере.
Суть в том, что для того, чтобы кислота могла растворять стекло, она должна быть кислотой на основе фтора .
Как различные кислоты растворяют стекло?
Здесь я объяснил, как различные кислоты на основе фтора реагируют со стеклом, растворяя его, а также некоторые происходящие химические реакции.
Плавиковая кислота
Возможно, наиболее распространенным является фтористоводородная кислота (HF), которая состоит из фтора и водорода, образующих кислоту при смешивании с водным раствором.
Плавиковая кислота действительно очень эффективно растворяет стекло, в результате чего от него ничего не остается.
То, как работает эта реакция, основано на том факте, что фтор имеет такую высокую электроотрицательность (способность притягивать электроны).
Он буквально похищает атомы кремния из диоксида кремния и образует с ним новые связи, образуя вещество под названием 9.0027 тетрафторид кремния . Происходит следующая химическая реакция:
Существует также другой вариант реакции, которая может произойти вместо гексафторкремниевой кислоты :
Обе эти реакции растворяют диоксид кремния (стекло) в процессе. Это связано с тем, что соединения, полученные в результате реакции (тетрафторид кремния и гексафторкремниевая кислота), будут растворяться в воде, которая также образуется в результате реакции.
Самое интересное, что здесь может быть тот факт, что фтористоводородная кислота даже не считается сильной кислотой, но все же обладает чрезвычайно сильной способностью растворять многие вещи, включая стекло.
Фторсурьмяная кислота
Другая кислота, растворяющая стекло (которая также основана на фторе), представляет собой фторсурьмяную кислоту (H 2 FSbF 6 ).
Фторсурьмяная кислота — это суперкислота , которая легко в триллионы раз сильнее плавиковой кислоты (по определению, даже без преувеличения) и считается самой сильной кислотой в мире.
Так что, разумеется, эта кислота легко растворяет стекло. Практически единственный способ хранить фторантимоновую кислоту — в тефлоновый контейнер , так как тефлон состоит из очень прочных углерод-фтористых связей, поэтому даже суперкислота его не растворит.
Практически единственный способ хранить фторантимоновую кислоту — в тефлоновый контейнер , так как тефлон состоит из очень прочных углерод-фтористых связей, поэтому даже суперкислота его не растворит.
Пятифтористая сурьма
Еще одна кислота, растворяющая стекло при контакте с ней, — это пятифтористая сурьма (SbF 5 ). Загвоздка здесь в том, что его водный раствор (кислоты обычно представляют собой водные растворы) фактически образует плавиковую кислоту.
Это связано с тем, что пентафторид сурьмы будет реагировать с водой с образованием фтористого водорода (= фтористоводородной кислоты) одним из следующих способов (второй способ также требует некоторого количества тепла):
Образовавшаяся фтористоводородная кислота будет реагировать с диоксидом кремния в стекле, растворяя его. Вот почему, например, Национальная медицинская библиотека США не рекомендует хранить пентафторид сурьмы во влажной или сырой среде (поскольку влага содержит воду) или в стеклянных контейнерах.
 А. Химия и технология древних и средневековых стекол. Минск, Изд-во АН БССР, 1969;
А. Химия и технология древних и средневековых стекол. Минск, Изд-во АН БССР, 1969; org/c/chemistry/acid/rwa/How-Can-A-Weak-Acid-Dissolve-Glass/. По состоянию на 26 января 2022 г.
org/c/chemistry/acid/rwa/How-Can-A-Weak-Acid-Dissolve-Glass/. По состоянию на 26 января 2022 г.