Виды щеколд: что это такое? Установка замков-щеколд, деревянные щеколды и поворотные, с пружиной и другие
- Врезка задвижки, установка щеколды в металлическую дверь
- Виды дверных замков и засовов, мебельные и столярные
- Реакция Хека — Химия LibreTexts
- Реакция Хека
Врезка задвижки, установка щеколды в металлическую дверь
Установка задвижки профессионалами ZamService – вот, что нужно для эффективной защиты вашего имущества. Проверенное временем качество механизмов выгодно отличает производителя от других. Если у вас возникли проблемы со старым замком или вы хотите установить дополнительную задвижку в дверь, воспользуйтесь нашими услугами.
Установить щеколду или задвижку на металлическую дверь
Вы купили в магазине или заказали у производителя новую металлическую входную дверь, но к сожалению на ней отсутствует или не установлена, не было предусмотрено конструкцией необходимая вам щеколда? Хотите установить задвижку на старую входную металлическую дверь, но у вас нет инструментов или вы не знаете как? Требуется установить засов или внутреннюю ночную задвижку, но просто боитесь, что можете испортить дверь? Если вы читаете этот текст, значит, вы нашли именно ответы на все вопросы. Компания ZamService занимается многими видами работ по установке и ремонту замков, задвижек и щеколд, наши мастера легко и быстро помогут установить и врезать любую конфигурацию или модель на ваш выбор, дверной задвижки, при сохранении цельности и качества дверного проема и двери.
Металлические двери – врезать или установить задвижку
Различные виды щеколд, дверных засовов и задвижек на металлические двери, это практически всегда самый необходимый аксессуар для металлических дверей которые устанавливаются на входе в дом. Выполняет функцию дополнительной защиты от проникновения при закрытых дверях. Материалы, из которых изготавливаются дверные задвижки различные, поэтому и применение для ограничения открытия двери тоже разное. В зависимости от назначения двери устанавливаются задвижки выполненные из металлопластика, полностью металлические или из других материалов.
Какую задвижку поставить: накладную или врезную?
Задвижка на дверь представляет собой специальный подвижный ригель, который поворачиваясь по своей оси, задвигается в специально вырезанную выемку для нее в коробке, тем самым закрывая доступ к открытию двери извне. Есть два типа задвижек, которые обычно устанавливаются на входные дверные полотна (металлические или деревянные) – врезные (обычно применяемые для крепких дверных полотен) или накладные. Врезная модель обычно устанавливается на металлических дверях, на входе в дом, задвижка отличается тем, что более надежно защищает дверь от вскрытия, а также используется свой метод врезки и способ установки. Такая поворотная задвижка, профессионально установленная на двери, может выдерживать очень большое давление, в зависимости от классности двери и дверного проема, до нескольких тонн.
Врезная модель обычно устанавливается на металлических дверях, на входе в дом, задвижка отличается тем, что более надежно защищает дверь от вскрытия, а также используется свой метод врезки и способ установки. Такая поворотная задвижка, профессионально установленная на двери, может выдерживать очень большое давление, в зависимости от классности двери и дверного проема, до нескольких тонн.
Раньше в основном на двери устанавливали накладные щеколды, которые крепились на уголок, закрепленный на двери. Сама по себе выдвижная щеколда является так же отличным способом защиты и намного лучше чем накладная цепочка. Если бы не один маленький недостаток – при захлопывании дверей щеколда может сдвинуться, таким образом запирая дверь изнутри. Вы, оказавшись снаружи, даже имея ключи от дверного замка, уже никак не сможете открыть двери, это становилось большой проблемой. Как открыть задвижку изнутри, при этом, не повреждая дверное полотно и не ломая дверную коробку? Компания ZamService поможет в решении этого вопроса.
Крепление задвижки на металлическое дверное полотно, как это лучше сделать?
Практически на каждой двери устанавливается удобная ночная задвижка, из большинства устанавливаемых задвижек пользуется популярностью врезная – она имеет закрытый тип и удобна в использовании, закрывается при помощи поворота, не имеет случаев самопроизвольного закрытия при захлопывании дверей. При установке такой задвижки полотно двери наиболее плотно прилегает к коробке, выдерживает большее давление в отличие от накладной.
Для простого фиксирования обычных дверей в подсобных или прилегающих помещениях в основном используют накладные задвижки, для входных – врезные. При использовании накладной задвижки на дверях, корпус устанавливается непосредственно на край дверного полотна, а планка, в которую задвигается щеколда, на дверной косяк.
Процесс установки проходит такие этапы: высверливание посадочного места для корпуса задвижки в торце двери, формирование специального кармана в ответной части дверной коробки и монтирование туда запорного ригеля, высверливание отверстия подходящее по диаметру к штоку с внутренней стороны двери и установка поворотника.
Входная дверь, профессиональная врезка задвижки
Замки или задвижки для входной двери врезаются в зависимости от самой конструкции дверного полотна, так, чтобы наиболее плотно прилегать к ребрам жесткости. Самое лучшее расположение задвижки это разместить ее между двумя замками, но в случае, если замки расположены близко друг к другу, врезаются выше или ниже замков.
В случае, если на дверном полотне использован оргалит, который оббивается дермантином, врезать задвижку становится довольно проблематично, так как вертушка на мягком оргалите закрепить практически невозможно, в отличие от дверного полотна изготовленного из металла или МДФ – в такие двери врезать задвижку и надежно ее закрепить можно очень легко.
Чтобы заказать услугу по ремонту, замене или установке дверных замков нужно просто позвонить +7 499 213 02 92.
Виды дверных замков и засовов, мебельные и столярные
Главная / Клей, соединения, фурнитура / Замки и запоры
Замок — это один из наиболее часто используемых механизмов для фиксации дверей, окон, ящиков в изделиях мебели и столярных изделиях. Основой этого скобяного изделия является защелка, которая, смещаясь прямолинейно, входит в гнездо, установленное в стойке. В столярных изделиях замки могут устанавливаться с помощью винтов или заделываться в древесину как на лицевую сторону, так и на кромку (например в замках с ключом, которые являются и наиболее надежными, и наиболее широко используемыми).
Основой этого скобяного изделия является защелка, которая, смещаясь прямолинейно, входит в гнездо, установленное в стойке. В столярных изделиях замки могут устанавливаться с помощью винтов или заделываться в древесину как на лицевую сторону, так и на кромку (например в замках с ключом, которые являются и наиболее надежными, и наиболее широко используемыми).
В замках с ключами часть замка, которая устанавливается в окладе, и та его часть, которая находится в раме или в стойке, спрятаны, при закрытой створке видны только накладка или пластинка на замочной скважине. Используя такой тип механизмов, необходимо помнить: толщина продольного бруса должна быть достаточной для того, чтобы разместить гнездо и тем самым не ослабить конструкцию стойки, в которой это гнездо выдалбливается, так как та часть замка, которая установлена в окладе, является более жесткой и имеет больше креплений — следовательно, для нее требуется более широкое гнездо.
Мебельный замок универсального типа для заделывания в древесину | Мебельный замок цилиндрического типа для дверей и ящиков | Мебельный замок, размещаемый на лицевой стороне для обычных изделий и устанавливаемый без заделывания в древесину |
Столярный замок, устанавливаемый на видимой стороне двери, с полностью видимыми коробкой и собачкой | Мебельный замок, заделываемый на кромке и применяющийся для дверец шкафов и ящиков | Столярный замок с рукояткой к внутренней стороне двери и ключом к наружной стороне |
Типы замков
Замки можно подразделить на две группы: мебельные и столярные. Мебельные замки. Замок универсального типа вставляется в гнездо на лицевой стороне. Для дверей и ящиков можно устанавливать замок цилиндрического типа, он запирается как влево, так и вправо. Для обычных изделий можно использовать замок на его лицевой стороне, который устанавливается без заделывания в древесину, язычок такого замка выдвигается наружу направо или налево, входя в гнездо, выдолбленное снаружи.
Мебельные замки. Замок универсального типа вставляется в гнездо на лицевой стороне. Для дверей и ящиков можно устанавливать замок цилиндрического типа, он запирается как влево, так и вправо. Для обычных изделий можно использовать замок на его лицевой стороне, который устанавливается без заделывания в древесину, язычок такого замка выдвигается наружу направо или налево, входя в гнездо, выдолбленное снаружи.
Столярные замки. Столярные замки используются главным образом для входных дверей, дверей кабинетов и тех помещений, которые нет необходимости запирать на ключ (например ванных комнат). Задвижка приводится в движение одним или двумя поворотами стопора.
Кроме рассмотренных выше замков, существует также огромное множество затворов и задвижек. Это засовы и щеколды, шпингалеты, задвижки, полозки для раздвижных дверей и гидравлических пружин, которыми такие двери оснащаются для движения и фиксации, по крайней мере, у одной из ее частей, а также для опор деревянного оклада дверей и окон.
Засовы и щеколды
Эти механизмы состоят из металлической детали, которая скользит и запирает, проталкивая палец с бобышкой или набалдашник рукоятки. Засовы могут различаться по форме и длине: вертикальный засов (наиболее часто используемый в столярных работах), засовы со шпингалетом (который служит для того, чтобы запирать двухстворчатые или многостворчатые двери, и вставляется в гнездо, сделанное в кромке, а задвижка фиксируется поднятием или опусканием рычажка). Засовы типа креста или щеколды устанавливаются на лицевой стороне и не требуют никакой подгонки.
Вертикальный засов, используемый для дверей и окон в столярных работах | Засов со спицей для вставки в гнездо на кромке | Шпингалет, устанавливаемый на лицевой стороне | Шпингалет-щеколда, устанавливаемый на лицевой стороне | Шпингалет типа испанка, устанавливаемый на лицевой поверхности в окладе окна |
Шпингалеты
Окна и балконные двери обычно запираются с помощью щеколд различного типа. Щеколда состоит из спицы, заканчивающейся на концах крючками, которые всаживаются в дверной косяк с помощью соответствующего крепежа. Спица зажимается привинченными пластинками, называющимися мостиками. Бобышка на спице заставляет ее поворачиваться и открывать крючки и проходит между мостиками.
Щеколда состоит из спицы, заканчивающейся на концах крючками, которые всаживаются в дверной косяк с помощью соответствующего крепежа. Спица зажимается привинченными пластинками, называющимися мостиками. Бобышка на спице заставляет ее поворачиваться и открывать крючки и проходит между мостиками.
Реакция Хека — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 69095
Реакция Хека — известная химическая реакция, открытая Мизороки и Хеком в 1972 через независимое исследование. Он включает реакцию перекрестного сочетания между органогалогенидами и алкенами, эти два вещества реагируют в присутствии палладиевого катализатора и основания с образованием замещенного алкена:
Рисунок 1: Общая реакция типа Хека [1] .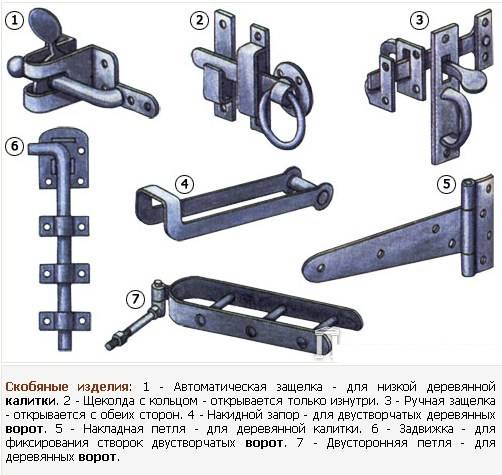 Рисунок 2: Каталитический цикл реакции Хека [1] .
Рисунок 2: Каталитический цикл реакции Хека [1] .
Стадия А представляет собой окислительное добавление полярного субстрата к палладиевому катализатору с образованием тетразамещенного комплекса. Стадия Б представляет собой миграционное введение олефина в систему. Стадия C представляет собой удаление β-гидрида алкена, а стадия D представляет собой добавление основания к палладию для регенерации исходного катализатора и замыкания цикла 9.0030 [1] .
Подробное изучение механизма реакции Хека
Предварительная активация палладиевого катализатора
Следует отметить, что первой стадией каталитического цикла фактически не является окислительное добавление субстрата, так как палладиевый катализатор должен быть активирован перед реакцией . Поэтому тщательное изучение структуры палладиевого катализатора и его свойств будет важно для понимания реакций Хека [2] . Каталитический предшественник Pd(II)(OAc) 2 , связанный с монодентатными фосфиновыми лигандами, такими как PPh 3 , обычно используется для катализа реакции, но этот комплекс Pd(II) должен быть восстановлен до Pd(0) для того, чтобы войти в каталитический цикл. Существует два различных механизма, включающих восстановление Pd(II) с помощью фосфина [2] :
Существует два различных механизма, включающих восстановление Pd(II) с помощью фосфина [2] :
Рис. 3: Механизм внешней оболочки для предварительной активации палладиевого катализатора [2] Рис. предварительная активация палладиевого катализатора [2]
Прекурсор катализатора Pd(II)(OAc) 2 , связанный с монофосфиновыми лигандами, намного эффективнее катализирует реакции Хека по сравнению с катализатором Pd(0)(PPh 3 ) 4 . Это связано с тем, что Pd(0)(PPh 3 ) 2 (OAc) — может быть дестабилизирован взаимодействием между OAc — и протонами с образованием нестабильного Pd(0)(PPh 3 ) 2 катализатор, который затем поступает в каталитический цикл для катализа реакции [3] . Поскольку Pd(0)(PPh 3 ) 4 является относительно стабильным 18-электронным комплексом, маловероятно, что он диссоциирует два лиганда с образованием нестабильной 14-электронной структуры [3] .
Рисунок 5: Эффект дестабилизации между Pd(0)(PPh 3 ) 2 (OAc) — и протоном, образующимся при гидролизе фосфония Рисунок 6: Диссоциация лиганда из Pd(PPh 3 ) 4 для создания активного палладиевого катализатора
Кроме того, катализаторы Pd(0) должны иметь соответствующее координационное число, чтобы войти в каталитический цикл [2] . Если имеется слишком много монофосфиновых лигандов, это может ингибировать катализатор, поскольку через ассоциацию лигандов будет образовываться координационно-насыщенный комплекс металла:
Рисунок 7: Дезактивация палладиевого катализатора
помощи фосфинов. Например, триэтиламин является хорошим реагентом для селективного восстановления Pd(II):
Рис. 8: Восстановление комплекса Pd(II) до Pd(0) в присутствии триэтиламина
Окислительное присоединение
Окислительное присоединение является наиболее сложной стадией всего каталитического цикла. Однако присутствие электронодонорных групп на фосфиновых лигандах может активировать катализатор Pd (0), так что связь R-X может быть легко разрушена вместе с образованием связи Pd-R и Pd-X. Скорость окислительного присоединения также зависит от химических свойств галогенидов, обычно наблюдается следующая тенденция [2] :
Однако присутствие электронодонорных групп на фосфиновых лигандах может активировать катализатор Pd (0), так что связь R-X может быть легко разрушена вместе с образованием связи Pd-R и Pd-X. Скорость окислительного присоединения также зависит от химических свойств галогенидов, обычно наблюдается следующая тенденция [2] :
Добавление олефина к комплексу палладия
Перед миграционным введением олефина в связь палладий-R олефин должен сначала ассоциироваться с комплексом палладия , 900 33, который требует диссоциации существующие лиганды. Исторически реакция Хека рассматривалась как функционализация олефинов через арилгалогениды, как правило, без лигандов для арилиодида или с монодентатными фосфинами для других соединений [1] . В этом цикле образуется прочная связь Pd-X, в то время как существует слабое присоединение Pd-PR 3 . Надвигающаяся группа атакует и образует чистую нейтральную квадратную плоскую молекулу, как показано на пути А. Было обнаружено, что этот механизм реакции не идеален, поскольку «хелатирующие дифосфины… в целом не производят полезных катализаторов [1] ». Эта проблема была решена путем введения трифлатов в качестве уходящих групп, что позволило бы этапу координации-вставки механизма следовать по пути B. Для определения этих путей были использованы каталитические и стехиометрические исследования.
Было обнаружено, что этот механизм реакции не идеален, поскольку «хелатирующие дифосфины… в целом не производят полезных катализаторов [1] ». Эта проблема была решена путем введения трифлатов в качестве уходящих групп, что позволило бы этапу координации-вставки механизма следовать по пути B. Для определения этих путей были использованы каталитические и стехиометрические исследования.
Рисунок 9: Ассоциация олефинов с комплексом палладия двумя различными путями
- Путь A: Если диссоциирует нейтральный лиганд, то в реакции преобладает нейтральный механизм. Нейтральный механизм имеет место, когда X=Cl, Br, I (т.е. сильный сигма-донор).
- Путь B: Если диссоциирует анионный галогенидный лиганд, то в реакции преобладает катионный механизм. Считается, что катионный механизм имеет место, когда X = OTs – или OAc –9.0026 (например, слабоассоциированный лиганд).
Два механизма, показанные выше, отображают возможные пути координации-вставки, обнаруженные в реакциях Хека. Было обнаружено, что внедрение этилена в связь Pt-H имеет решающее значение для характеристики реакции [1] . Торн и Хоффман провели орбитальные исследования, чтобы получить ключевую информацию на этом этапе. Первый вывод, к которому они пришли, заключается в том, что для встраивания должна существовать компланарная сборка металла, гидрида и этилена. Это указывало на то, что вставка является стереоселективной и происходит синхронным образом. Экспериментальные данные подтверждают это утверждение [1] . Они также определили, что энергетический барьер для пентакоординированного комплекса значительно выше, чем для тетракоординированного комплекса, что указывает на то, что пентакоординированные комплексы не участвуют в механизме. Это наблюдение было подтверждено кинетическими и экспериментальными данными [1] .
Было обнаружено, что внедрение этилена в связь Pt-H имеет решающее значение для характеристики реакции [1] . Торн и Хоффман провели орбитальные исследования, чтобы получить ключевую информацию на этом этапе. Первый вывод, к которому они пришли, заключается в том, что для встраивания должна существовать компланарная сборка металла, гидрида и этилена. Это указывало на то, что вставка является стереоселективной и происходит синхронным образом. Экспериментальные данные подтверждают это утверждение [1] . Они также определили, что энергетический барьер для пентакоординированного комплекса значительно выше, чем для тетракоординированного комплекса, что указывает на то, что пентакоординированные комплексы не участвуют в механизме. Это наблюдение было подтверждено кинетическими и экспериментальными данными [1] .
Путь B был неизвестен до 1991 года, когда Одзава и Хаяси предположили существование катионной формы квадратно-плоского комплекса. Для получения этого комплекса в качестве уходящей группы 9 необходимо использовать трифлаты.0030 [1] . Этому способствует лабильность связей Pd-OTf в окислительно-аддитивном комплексе. Бидентатные лиганды фосфора или азота вместе с уходящей группой трифлата позволяют реакции идти по этому пути. Также было установлено, что этот путь может давать высокую асимметричную индукцию, когда дифосфин является хиральным. Этот эффект не наблюдался в пути A [1] .
Для получения этого комплекса в качестве уходящей группы 9 необходимо использовать трифлаты.0030 [1] . Этому способствует лабильность связей Pd-OTf в окислительно-аддитивном комплексе. Бидентатные лиганды фосфора или азота вместе с уходящей группой трифлата позволяют реакции идти по этому пути. Также было установлено, что этот путь может давать высокую асимметричную индукцию, когда дифосфин является хиральным. Этот эффект не наблюдался в пути A [1] .
На механизмы диссоциации лиганда также влияют различные типы фосфиновых лигандов. Монодентатные фосфиновые лиганды приводят к возникновению как нейтрального, так и катионного механизмов, тогда как бидентатные фосфиновые лиганды лишь индуцируют катионный механизм, но нейтральный механизм все еще возможен при наличии большого угла захвата [2] .
Мигрирующее внедрение
Мигрирующее внедрение олефина в связь Pd-R является важным этапом каталитического цикла, поскольку оно может контролировать стереоселективность и региоселективность реакций Хека. Для нейтрального комплекса палладия региоселективность определяется стерическими свойствами, что означает, что нуклеофильная атака происходит на менее затрудненном участке алкена [4][5] :
Для нейтрального комплекса палладия региоселективность определяется стерическими свойствами, что означает, что нуклеофильная атака происходит на менее затрудненном участке алкена [4][5] :
Рисунок 10: Региоселективность для нейтральных комплексов палладия 9Рис.
Отщепление β-гидрида
Отщепление β-гидрида приводит к продукту реакции Хека, который представляет собой новый замещенный алкен. На этом этапе палладий и присоединенный к нему гидрид должны быть синкомпланарными для инициирования элиминации. Продукт с Z-конформацией сильно неблагоприятен из-за стерического взаимодействия в переходном состоянии [2] :
нежелательного продукта Хека [4] :
Рис. 13: Изомеризация олефинов
Эти побочные реакции будут происходить, поскольку это обратимая реакция. Эта проблема возникает, если скорость диссоциации олефинов слишком низкая.0030 [1] . К счастью, добавление оснований или солей серебра может значительно снизить вероятность изомеризации алкенов за счет облегчения восстановительного отщепления с образованием связи H-X [6] .
К счастью, добавление оснований или солей серебра может значительно снизить вероятность изомеризации алкенов за счет облегчения восстановительного отщепления с образованием связи H-X [6] .
Регенерация палладиевого катализатора
Добавление основания необходимо для восстановления комплекса L 2 PdHX обратно в исходный L 2 Pd(0) [1] . Некоторыми широко используемыми основаниями являются триалиламины, такие как Et 3 N, или неорганические соли, такие как AcONa. Протонная губка или соли Tl(I) или Ag(I) также могут быть использованы для замыкания цикла [1] .
Внутримолекулярная реакция Хека
Реакции Хека также можно проводить в одной молекуле, что весьма полезно для макроциклизации. Впервые об этой внутримолекулярной реакции Хека сообщили Мори и Бан в 1977 г.:
Mori, M; Банк.; Tetrahedron 1977, 12, 1037
Внутримолекулярная реакция Хека имеет много преимуществ по сравнению с межмолекулярной реакцией Хека. Во-первых, только моно- или дизамещенные алкены могут координироваться в комплекс палладия в межмолекулярной реакции Хека, тогда как три- и четырехзамещенные алкены способны легко участвовать по внутримолекулярному механизму. Во-вторых, внутримолекулярная реакция Хека намного эффективнее межмолекулярной из-за энтропийных соображений [7] . Наконец, региоселективность и стереоселективность резко улучшаются во внутримолекулярной реакции Хека. Это преимущество вдохновило Шибасаки и Овермана на исследование асимметричного эффекта во внутримолекулярной реакции Хека, и в конце концов они обнаружили первые асимметричные внутримолекулярные реакции Хека. Это замечательное открытие пролило свет на синтез натуральных продуктов [7] .
Во-первых, только моно- или дизамещенные алкены могут координироваться в комплекс палладия в межмолекулярной реакции Хека, тогда как три- и четырехзамещенные алкены способны легко участвовать по внутримолекулярному механизму. Во-вторых, внутримолекулярная реакция Хека намного эффективнее межмолекулярной из-за энтропийных соображений [7] . Наконец, региоселективность и стереоселективность резко улучшаются во внутримолекулярной реакции Хека. Это преимущество вдохновило Шибасаки и Овермана на исследование асимметричного эффекта во внутримолекулярной реакции Хека, и в конце концов они обнаружили первые асимметричные внутримолекулярные реакции Хека. Это замечательное открытие пролило свет на синтез натуральных продуктов [7] .
Shibasaki, M.J. Org. хим. 1984,54,4738
Overman, L.E.J. Org. хим. 1989, 54, 5846
Региоселективность и стереоселективность
Реакции региоселективности Пути А были проведены на нескольких классах олефинов. Различные семейства олефинов реагируют с разной региоселективностью [1] . Как только арилтрифлаты были введены в качестве уходящих групп, реакции по пути B также исследовали на предмет региоселективности. Эти реакции проводились с отходящими группами арилтрифлата и арилгалогенидами с Pd(OAc) 2 с бидентатными лигандами фосфора [1] . Эти реакции давали разветвленные продукты с большей готовностью, чем путь A.
Различные семейства олефинов реагируют с разной региоселективностью [1] . Как только арилтрифлаты были введены в качестве уходящих групп, реакции по пути B также исследовали на предмет региоселективности. Эти реакции проводились с отходящими группами арилтрифлата и арилгалогенидами с Pd(OAc) 2 с бидентатными лигандами фосфора [1] . Эти реакции давали разветвленные продукты с большей готовностью, чем путь A.
В пути A региоселективность связана с путем координации-вставки и стерическими факторами. Было замечено, что миграция группы R к менее замещенному углероду с образованием линейных продуктов благоприятна для пути A [1] . Путь Б отличается тем, что в определении региоселективности преобладают электронные факторы. Увеличение поляризации определяется координацией пи-системы внутри катионного комплекса. Это вызывает селективную миграцию арильного фрагмента на углерод с меньшей плотностью заряда [1] .
Hayashi и Ozawa исследовали стереоселективные межмолекулярные реакции с использованием арилтрифлата в качестве уходящей группы и хирального ( R )-BINAP. Несколько реакций были проведены в аналогичных условиях и их продукты сравнивались [1] . Как и ожидалось с уходящей группой трифлата, эти реакции шли по пути B. В этих реакциях хиральный лиганд BINAP прочно связывается с металлом через оба его атома фосфора. Этот хиральный лиганд способен передавать свою хиральную информацию от катализатора к субстратам [1] . Было обнаружено, что эти реакции являются наиболее селективными при использовании как хирального BINAP, так и уходящей группы трифлата. Следует отметить, что это ( R )-BINAP определение селективности будет происходить только в системах, богатых электронами. Эта информация согласуется с утверждением, что путь B в значительной степени зависит от электронных факторов, поскольку системы, богатые электронами, реагируют гораздо эффективнее, чем бедные электронами [1] .
Оверман сообщил о стереоселективном синтезе четвертичных атомов углерода посредством асимметричных внутримолекулярных реакций Хека. Эти результаты были примечательны, поскольку они не соответствовали широко распространенному мнению о том, что длительное время реакции приводит к изомеризации двойной связи и образованию множественных продуктов [1] . ПМП использовали в качестве основания в этих реакциях без присутствия соли Ag(I). В этих реакциях наблюдалась хорошая селективность, несмотря на медленное время реакции и трудности передачи хиральности по Пути A [1] . Было установлено, что на гибких подложках продукты были практически рацемическими. Однако на жестких подложках единственная координация фосфора ( R )-BINAP все еще была способна передавать хиральность по пути A9.0030 [1] .
Ограничения реакции Хека
Реакция Хека широко используется в фармацевтике, медицине и промышленности благодаря ее способности эффективно генерировать большие полициклические структуры. Однако эта синтетически полезная реакция имеет свои недостатки [8] .Один из основных недостатков заключается в том, что катализатор Pd будет потерян в конце каталитического цикла, поэтому исследователям необходимо найти эффективный метод повторно использовать палладиевый катализатор. Еще одним существенным недостатком является то, что фосфиновые лиганды, присоединенные к палладиевому катализатору, могут быть токсичными и дорогими, поэтому для повышения эффективности реакции необходимо найти лиганды, не содержащие фосфин.0025 [8] .
Однако эта синтетически полезная реакция имеет свои недостатки [8] .Один из основных недостатков заключается в том, что катализатор Pd будет потерян в конце каталитического цикла, поэтому исследователям необходимо найти эффективный метод повторно использовать палладиевый катализатор. Еще одним существенным недостатком является то, что фосфиновые лиганды, присоединенные к палладиевому катализатору, могут быть токсичными и дорогими, поэтому для повышения эффективности реакции необходимо найти лиганды, не содержащие фосфин.0025 [8] .
Применение реакции Хека
• Соединения Хека с лактоном дегидрокостуса и арилгалогенидами могут продуцировать производные сесквитерпеновых лактонов гваянолида, которые доказали свою эффективность в ингибировании резистентных клеток острого лейкоза:
Y. H. Ding, H. X. Фан, Дж. Лонг , К. Чжан, & Ю. Chen , Письма по биоорганической и медицинской химии, vol. 23, 22, 6087–6092, 2013.
• Реакцию Хека также можно использовать для синтеза средства для прекращения курения, Chantix ®
Коу, Дж. В.; Брукс, PR; Ветелин, М.Г.; Башор, К.Г.; Бьянко, К.; Флик, А., А.С. Тетраэдр Летт . 2011, 52, 953-954
В.; Брукс, PR; Ветелин, М.Г.; Башор, К.Г.; Бьянко, К.; Флик, А., А.С. Тетраэдр Летт . 2011, 52, 953-954
Ссылки
- Cabri, W.; Кандиани, И. Акк. хим. Рез. 1995 , 28, 2-7.
- Тамбар, Великобритания (2003 г., 17 апреля). Черт возьми: механистическое понимание синтетически полезной реакции. Литературная серия Stoltz Group.
- Ютанд, А. (2009 г., 17 февраля). Механизм реакции Мизороки-Хека. Реакция Мизороки-Хека, 1-50. дои: 10.1002/9780470716076.ch2
- Хейдл, А., Муссо, Дж., и Лю, Ф. (nd). Хек Реакция. Получено 6 декабря 2016 г. с http://faculty.chemistry.harvard.edu/files/myers/files/heck-matt1.pdf
- Кабри, В.; Кандиани, И.; Бедески, А .; Пенко, С.; Санти, Р.Дж. Орг. Химия . 1992 , 57, 1481-1486
- Абельман, М. М.; О, Т.; Оверман, Л. Э. Ж. Орг. Химия . 1987 , 52, 4133-4135
- Ноулз, Р.
 (2004, 14 июля). Внутримолекулярная реакция Хека, собрание группы Макмиллана
(2004, 14 июля). Внутримолекулярная реакция Хека, собрание группы Макмиллана - Зазыбин А. (2010, 22 января). Металлоорганическая химия и гомогенный катализ. Получено 6 декабря 2016 г. с http://sas.k.u-tokyo.ac.jp/AZ/Lecture12.pdf
.
.
Авторы и авторство
- Хейли Мерритт и Ифань Ци
Heck Reaction распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Реакция Хека
Портал органической химии
Реакции >> Имя Реакции
Дополнительная информация
Литература
Родственные реакции
Соединение Стиле
Алкенилирование
катализируемая палладием связь CC между арилгалогенидами или винилгалогенидами
и активированные алкены в присутствии основания упоминаются как «Хек
Реакция». Последние разработки в области катализаторов и условий реакции.
привели к гораздо более широкому кругу доноров и акцепторов.
поддается реакции Хека.
Один из
Преимуществом Heck Reaction является его выдающийся транс
селективность.
Последняя литература
Трифункциональные N,N,O -тердентатные амидо/пиридилкарбоксилатные комплексы Pd(II)
были высокоактивными и стабильными бесфосфиновыми катализаторами Хека и
реакции Сузуки при комнатной температуре с высокими числами оборота.
М. Л. Кантам, П. Шринивас, Дж. Ядав, П. Р. Лихар, С. Бхаргава, J. Org. хим. , 2009 ,
74 , 4882-4885.
Новый N-гетероциклический карбен-палладиевый комплекс/матрица ионной жидкости, иммобилизованная
на диоксиде кремния: применение в качестве извлекаемого катализатора для реакции Хека
Б. Карими, Д. Эндерс, Org. лат. , 2006 ,
8 , 1237-1240.
Pd(хинолин-8-карбоксилат) 2 по низкой цене,
Катализатор, не содержащий фосфина, для реакций Хека и Судзуки
X. Цуй, Дж. Ли, З.-П. Чжан, Ю. Фу, Л. Лю, К.-Х. Го, J. Org. хим. , 2007 ,
72 , 9342-9345.
1,1′-Метилен-3,3′-бис[( N -( трет--бутил)имидазол-2-илиден] и
Его влияние на катализируемое палладием соединение С-С
С. Надри, Э. Рафи, С. Джамали, М. Джошагани,
Synlett , 2015 , 26 , 619-624.
Реакции Хека, катализируемые ультрамалыми и однородными наночастицами палладия
Поддерживается на полианилин
L. Yu, Y. Huang, Z. Wei, Y. Ding, C. Su, Q. Xu, J. Org. хим. ,
Yu, Y. Huang, Z. Wei, Y. Ding, C. Su, Q. Xu, J. Org. хим. ,
2015 ,
80 , 8677-8683.
Эффективное хек-винилирование арилгалогенидов, катализируемое новым стабильным воздухом
Палладий-тетрафосфиновый комплекс
M. Feuerstein, H. Doucet, M. Santelli, J. Org. хим. , 2001 ,
66 , 5923-5925.
Высокоэффективные реакции Хека арилбромидов с n -бутилом
Акрилат, опосредованный системой солей палладия/фосфина-имидазолия
К. Ян, Х. Ман Ли, С. П. Нолан,
Орг. лат. , 2001 , 3 , 1511-1514.
Триэтаноламин как эффективное и многоразовое основание, лиганд и реакция
Среда для бесфосфановых катализируемых палладием реакций Хека
Х. Дж. Ли, Л. Ван, евро. Дж. Орг. хим. , 2006 ,
5101-5102.
Триарилфосфин-функционализированные N -гетероциклические карбеновые лиганды для Хека
реакция
А.-Э. Ван, Дж.-Х. Се, Л.-Х. Ван, К. -Л. Чжоу, Тетраэдр , 2005 ,
-Л. Чжоу, Тетраэдр , 2005 ,
61 , 259-266.
Эффективный и общий метод для связи Хека и Бухвальда-Хартвига
Реакции арилхлоридов
Д.-Х. Ли, А. Тахер, С. Хоссейн, М.-Дж. Джин, Орг. лат. , 2011 ,
13 , 5540-5543.
Катализируемая палладием реакция Хека арилхлоридов в мягких условиях
Продвигается органическими ионными базами
Х.-Дж. Сюй, Ю.-К. Чжао, X.-F. Чжоу, J. Org. хим. , 2011 ,
76 , 8036-8041.
Реакция Хека неактивированных алкилгалогенидов, индуцированная облучением, в помещении
Температура
Г.-З. Ван, Р. Шан, В.-М. Ченг, Ю. Фу, J. Am. хим. соц. , 2017 ,
139 , 18307-18312.
Эффективная реакция Хека в водной фазе, катализируемая прочным гидрофильным
Бисбензимидазолилиден-палладиевый клещевой комплекс с пиридиновым мостиком
Z. Wang, X. Feng, W. Fang, T. Tu, Synlett , 2011 ,
951-954.
Моноилидный комплекс палладациклфосфина является эффективным катализатором
реакция кросс-сочетания Мизороки-Хека ароматических или алифатических олефинов с
широкий спектр арилбромидов и хлоридов. Реакции протекают хорошо
выходы в присутствии низкого содержания палладия (10 частей на миллион) в аэробных условиях
условия. Высокая каталитическая активность с частотой оборотов до 20 000 ч -1
наблюдали при 130С.
С. Дж. Сабунчи, М. Ахмади, Т. Азизи, М. Панахимер, Synlett , 2014 , 25 ,
336-342.
Эффективный и простой протокол для бесфосфиновых реакций Хека в воде в
наличие комплекса Pd(L-пролин) 2 в качестве катализатора при
контролируемые условия микроволнового облучения универсальны и обеспечивают превосходное
выход продуктов за короткое время реакции. Реакционная система минимизирует затраты,
эксплуатационные риски и загрязнение окружающей среды.
Б. К. Аллам, К. Н. Сингх, Синтез , 2011 ,
1125-1131.
Соединения Хека при комнатной температуре в нанометровых водных мицеллах
Б. Х. Липшуц, Б. Р. Тафт, Org. лат. , 2008 ,
10 , 1329-1332.
Эффективные соединения Хека и Сузуки арилбромидов в водной фазе с использованием
Три(4,6-диметил-3-сульфонатофенил)фосфин тринатриевая соль (TXPTS)
Л. Р. Мур, К. Х. Шонесси, 9 лет0480 Орг. лит., 2004 , 6 ,
225-228.
Поли(этиленгликоль) (ПЭГ) в качестве многоразовой растворяющей среды для органических
Синтез. Application in the Heck Reaction
S. Chandrasekhar, C. Narsihmulu, S.S. Sultana, NR Reddy, Org. лат. , 2002 , 4 , 4399-4401.
Функционализированная ионная жидкость как эффективная и пригодная для повторного использования реакционная среда
для реакции Хека, катализируемой палладием, без фосфина
Л. Чжоу, Л. Ван,
Синтез , , 2006, , 2649-2652.
Гуанидиновые кислотно-основные ионные жидкости Бренстеда: новая реакционная среда для
Катализируемая палладием реакция Хека
С. Ли, Ю. Линь, Х. Се, С. Чжан, Дж. Сюй, Org. лат. , 2006 , 8 , 391-394.
Ли, Ю. Линь, Х. Се, С. Чжан, Дж. Сюй, Org. лат. , 2006 , 8 , 391-394.
Практический протокол соединения Хека-Мизороки для сложных субстратов
Опосредуется N-гетероциклическим лигированным карбеном палладациклом
Е. А. Б. Канчев, Г.-Р. Peh, C. Zhang, JY Ying, Org. лат. ,
2008 ,
10 , 3949-3952.
Реакция типа Мизороки-Хека борорганических реагентов с алкенами и
Алкины. Pd(II)-катализируемый путь с Cu(OAc) 2 в качестве окислителя
X. Ду, М. Сугуро, К. Хирабаяси, А. Мори, Т. Нишиката, Н. Хагивара, К. Кавата,
Т. Окэда, Х. Ф. Ван, К. Фугами, М. Косуги, Org. лат. , 2001 ,
3 , 3313-3313.
Катализируемое палладием декарбонилирующее алкенилирование различных бензойных кислот.
с концевыми алкенами дает соответствующие внутренние алкены в очень хорошей форме.
урожаи. Превращение коричных кислот и биоактивных бензойных кислот, таких как
3-метилфлавон-8-карбоновая кислота, пробенецид, адапалин и фебуксостат
продемонстрировать синтетическую ценность этой новой реакции.
В. Ю, Л. Лю, Т. Хуан, С. Чжоу, Т. Чен,
Орг. лат. , 2020 , 22 , 7123-7128.
Хирально-анион-опосредованная асимметричная реакция Хека-Мацуда ациклического алкенила
Спирты
Т. Чжан, В.-А. Ли, Х.-К. Шен, С.-С. Чен, З.-Ю. Хань, Орг. лат. , 2021 , 23 ,
1473-1477 гг.
Устойчивая процедура, сочетающая в себе преимущества однородной и
Гетерогенный катализ реакции Хека-Мацуды
К. Росси, Э. Фуке, Ф.-Х. Фелпин, Синтез , 2012 , 44 ,
37-41.
Оперативно простые и высокоселективные ( E )-стиренил-селективные реакции Хека
олефинов, несмещенных в электронном виде
Э. В. Вернер, М. С. Сигман, J. Am. хим. соц. , 2011 ,
133 , 9692-9695.
Pd- m BDPP-катализируемое региоселективное внутреннее арилирование электронно-обогащенных
Олефины Арил Галидес
С. Лю, Н. Берри, Н. Томсон, А. Петтман, З. Хайдер, Дж. Мо, Дж. Сяо, J. Org. хим. , 2006 , 71 , 7467-7470.
Мо, Дж. Сяо, J. Org. хим. , 2006 , 71 , 7467-7470.
Региоселективное винилирование олефинов с высоким содержанием электронов с помощью винилгалогенидов по Хеку:
Нейтральный путь в действии?
М. МакКонвилл, О. Саиди, Дж. Блэкер, Дж. Сяо, J. Org. хим. , 2009 ,
74 , 2692-2698.
Реакция Хека 2-оксиакрилатов с арилбромидами: общий путь к
Моноарилпируваты и ортоэфирзащищенные моноарилпируваты
К. Матча, К. Черниченко, К. Жувен, С. Б. Гудугунтла, Д. Н. Тран, С. Белл,
W. Paden, M. Figlus, C. Muir, C. H. Diaz, J. Org. хим. , 2022 , 87 ,
10736-10746.
Реакция Мизороки-Хека ненапряженных арилкетонов через промотированный лигандом CC
Бонд Олефинация
М.-Л. Ван, Х. Сюй, Х.-Ю. Ли, Б. Ма, З.-Ю. Ван, X. Ван, Х.-Х. Дай, Орг. лат. , 2021 , 23 ,
2147-2152.
Реакция Хека богатых электронами олефинов с региоконтролем
Доноры водородных связей
Дж. Мо, Дж. Сяо, Ангью. хим. Междунар. Эд. , 2006 , 45 , 4152-4157.
Мо, Дж. Сяо, Ангью. хим. Междунар. Эд. , 2006 , 45 , 4152-4157.
Комплекс палладий-тетрафосфин катализирует реакцию Хека винилбромидов
с алкенами: мощный доступ к сопряженным диенам
М. Лемхадри, А. Баттаче, Ф. Бертиол, Т. Заир, Х. Дусе, М. Сантелли, Синтез , 2008 ,
1142-1152.
Связывание Хека с неактивированными алкенилтозилатами и фосфатами: примеры
эффективных 1,2-миграций промежуточных соединений алкенилпалладия(II)
А. Л. Хансен, Ж.-П. Эбран, М. Алквист, П.-О. Норрби, Т. Скайдструп, Angew. хим. Междунар. Эд. , 2006 , 45 , 3349-3353.
Новый путь к синтезу ( E )- и ( Z )-2-алкен-4-иноатов и нитрилов из
vic -Диодо-( E )-алкены, катализируемые наночастицами Pd(0) в воде
BC Ranu, K. Chattopadhyay, Org. лат. , 2007 ,
9 , 2409-2412.
«Громоздкий, но гибкий» α-диимин-палладий-катализируемый восстановитель Heck
Кросс-сочетание: высокоселективное антимарковниковское гидроарилирование алкена в
Воздух
Х. -У. Ян, Д.-Х. Ли, А.-Х. Песня, Ф.-С. Лю, J. Org. хим. , 2020 , 85 ,
-У. Ян, Д.-Х. Ли, А.-Х. Песня, Ф.-С. Лю, J. Org. хим. , 2020 , 85 ,
11750-11765.
Синтез 2-виниловых индолов и их производных в тандеме, катализируемом палладием.
Реакция связывания
А. Файоль, Ю.-К. Фанг, М. Лаутенс, Org. лат. , 2006 , 8 , 4203-4206.
Heck Vinylations с использованием винилсульфида, винилсульфоксида, винилсульфона или
ПРОИЗВОДНЫЕ ВИНИЛСУЛЬФОНАТА И АРИЛБРОМИДЫ, КАТАЛИЗИРУЕМЫЕ КОМПЛЕКСОМ ПАЛЛАДИЯ
Получено из тетрафосфина
А. Баттас, Т. Заир, Х. Дусе, М. Сантелли,
Синтез , , 2006, , 3495-3505.
Отклоненная аэробная реакция Хека делает возможным избирательное образование 1,3-диена и
Синтез 1,3,5-триена посредством разрыва связи C-C
NJ McAlpine, L. Wang, B.P. Carrow, J. Am. хим. соц. ,
2018 ,
140 , 13634-13639.
Прямое ацилирование арилбромидов альдегидами с помощью палладиевого катализа
Дж. Руан, О. Саиди, Дж. А. Игго, Дж. Сяо, Дж. Ам. хим. соц. , 2008 ,
Саиди, Дж. А. Игго, Дж. Сяо, Дж. Ам. хим. соц. , 2008 ,
130 , 10510-10511.
Получение винилсилиловых эфиров и дисилоксанов с помощью силил-Хека.
Реакция силилдитрифлатов
С. Э. С. Мартин, Д. А. Уотсон, J. Am. хим. соц. , 2013 ,
135 , 13330-13333.
Прямой синтез алкенилборных эфиров из нефункционализированных алкенов.
Реакция Борила-Хека
У. Б. Рид, Дж. Дж. Спиллейн, С. Б. Краузе, Д. А. Уотсон, J. Am. хим. соц. , 2016 ,
138 , 5539-5542.
Синтез тризамещенных алкенилборных эфиров из алкенов с использованием
Реакция Борила-Хека
WB Reid, DA Watson, Org. лат. ,
2018 , 20 , 6822-6826.
Индуцированная облучением катализируемая палладием декарбоксилирующая реакция Хека
Алифатический N -(Ацилокси)фталимиды при комнатной температуре
Г.-З. Ван, Р. Шан, Ю. Фу, Org. лат. ,
2018 , 20 , 888-891.
 (2004, 14 июля). Внутримолекулярная реакция Хека, собрание группы Макмиллана
(2004, 14 июля). Внутримолекулярная реакция Хека, собрание группы Макмиллана